Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Équilibre liquide-vapeur
1. Préface:
Une distillation est une séparation des constituants d'un mélange. Filtrer une eau contenant des
matières en suspension est une séparation. Décanter um mélange
d'huile et d'eau l'est aussi. Chauffer une substance jusqu'à ébullition, puis receuillir le
produit évaporé à travers un réfrigérant est une distillation simple. Lorsque les forces intermoléculaires
des constituants dans le mélange sont approximativement du même ordre, comme pour le propane C3H8 et le butane C4H10, malgré que leur tension de vapeur ou pression de vapeur saturante est différente à une
température donnée, leur séparation ne peut se faire d'une manière simple. On utilise ainsi une distillation fractionnée qui permet
en outre de répondre à des besoins spécifiques comme la pureté de la vapeur produite dans une colonne de distillation.
Dans ce chapitre, nous allons étudier Les lois de Raoult et de Dalton et, en se servant des lentilles d'équilibre liquide-vapeur, étudier les premières notions de distillation en considérant des mélanges binaires (deux constituants dans le mélange), et idéaux (de liaisons moléculaires des constituants purs rompues dans le mélange et intermoléculaires formées sont approximativemnet identiques), et enfin voir la notion d'azéotropie.
2. Loi de Dalton:
Lorsqu'un constituant gazeux A est seul dans le volume V, alors
PA = nART/V
Lorsque le constituant gazeux B est seul dans le volume V, alors
PB = nBRT/V
Un gaz occupe tout le volume qui lui est offert.
Si ces deux constituants A et B forment un mélange, alors la pression PA du constituant A et
la pression PB du constituant B sont dites pressions partielles .
La pression totale exercée par le mélange est:
P = (nA + nB)RT/V = nART/V + nART/V = PA + PB
P = Σ Pi
Dans un gaz parfait, la pression totale exercée
par un mélange est égale à la somme des pressions partielles
des constituants.
3. Loi de Raoult
Dans un mélange de deux constiuants liquides A et B, la
fraction molaire de A dans le mélange est :
χA = nA /(nA + nB)
Où nA et nB représentent respectivement le nombe de moles de A et de B
dans le mélange.
La vitesse de vaporisation du constituant A est proportionnelle à sa fraction
molaire; ainsi, on peut donc ecrire: Vvap(A) = k1 χA.
Dans leur mélange gazeux, la pression partielle de A dans le mélange est :
γA = PA /(PA + PB)
Où PA et PB représentent respectivement les pression partielles de A et de B.
La vitesse de condensation de A est proportionnelle à sa pression partielle dans le mélange
gazeux; on peut donc ecrire: Vcond(A) = k2 PA
À l'équilibre, ses deux vitesses sont égales, alors:
k1 χA = k2 PA
Donc : PA = (k1/k2) χA
Pour une solution pure (constituant A est seul présent), χA = 1; alors: PA = k1/k2
On note généralement PA pur = PAo
PA = χA PA pur
La pression de vapeur saturante d'un constituant dans un mélange gazeux est
égale au produit de sa fraction molaire dans le liquide par sa pression
de vapeur saturante à l'état pur, à une température donnée.
4. Diagramme de pression
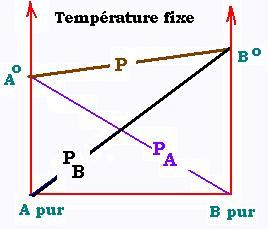
À température constante, on peut représenter l'évolution des
pressions en fonction des fractions molaires. Nous avons:
PA = χA PAo
PB = χB PBo
Ptotale = P = PA + PB
= χA PAo + χB PBo
P = (1 - χB) PoA + χB PoB
ou: P = PAo + χB (PBo - PAo )
5. Lentille d'équilibre
![]()
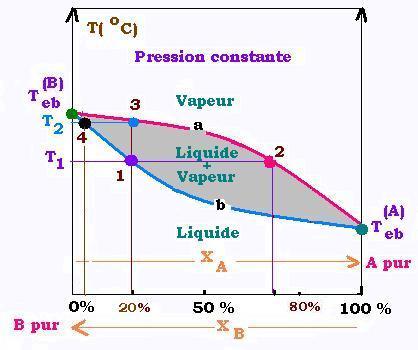
On dispose d'un mélange liquide de deux constituants A et B de frations molaires χA
et χB dans ce liquide, et de températures d'ébullition Teb(A) et Teb(B)
respectivement. La plus petite température d'ébullition correspond au constituant le plus volatil (ou léger); l'autre
correspond au constituant lourd.
Dans ce diagrame, A est le constituant le plus volatil, l'axe de fractions molaires (gradués de
0% à 100%) est orienté vers ce point A; de telle façon qu'à 100% de A (0% de B), on retrouve
le corps pur A.
Par convention, c'est toujours le plus volatil qu'on représente sur cet axe. Il
va de soi que son complément B à 100% est orienté dans le sens inverse. Ainsi,
on ne représente pas les fractions molaires relatives au constituant lourd; on les calcule
tout simplement à l'aide de la complémentarité à 100%.
L'axe des ordonnées représente les températures relatives à une solution de chaque mélange.
La partie inféreieure à la lentille représente la zone liquide, la lentille la zone liquide-vapeur,
et le dessus de la lentille représente la partie vapeur
Lorsqu'on élève la température de la solution (à T1 par exemple), c'est avec le constituant léger que ça apparait
la première bulle sur la courbe inférieure (courbe b) dite des points de bulle [point 1 sur la figure]. Le point
correspondant sur la courbe supérieure (courbe a) dite des points de rosée [point 2 sur la figure] donne
la fraction molaire correspondante en vapeur (ici 75%).
Si, pour le même mélange [20% du léger sur la figure], la température s'èlève (jusqu'à T2), on arrive au
point final (point 3) où la dernière goutte du liquide est entrain de disparaitre qui correspond à 10% en
fraction molaire liquide(donné par la verticale du point 4). En ce point (ici point 3) sur la coube de
rosée, la fraction molaire de vapeur se confont avec la fraction molaire dans le liquide (ici 20%).
6. Étude d'un flash et débits correspondants
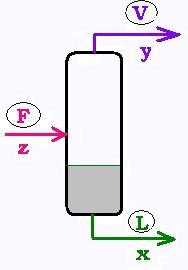
On appelle flash une séparation faite une seule fois. Le mélange
fluide binaire A - B entre dans le ballon, appelé charge. Dans celui-ci,
règne une température donnée T et une pression donnée P. Ainsi, une partie du
fluide V sort du ballon en vapeur, l'autre L en liquide. Sa lentille correspondante
donne les informations sur les pourcentages molaires: z est la fraction molaire de
A dans la charge (donc 1 - z) est celle de B dans cette charge. x et y sont les fractions
molaires liquide et vapeur dans le ballon, qui sont aussi celles qui
en sortent.
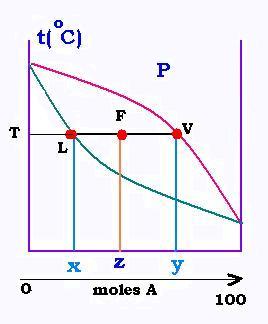
La conservation du flux à travers le ballon s'ecrit:
F = L + V (1)
La conservation des moles de A à travers le ballon s'ecrit:
z F = x L + y V (2)
(1) dans (2) donne:
z F = x L + y (F - L) = y F + (x - y) L, donc:
(x - y) L = (z - y) F, d'où:
L = [(y - z)/(y - x)]F = [(VF)/(VL)]F
V = F - L = F - [(y - z)/(y - x) ] F = F [z - x)/(y - x)]
D'où:
V = [(z - x)/(y - x)]F = [(FL)/(VL)]F
Dans une lentille d'équilibre, il suffit juste de mesurer
les segments de droite pour aboutir au valeur des débits de vapeur
et de liquide, connaissant le débit de charge F. Le volume V en
liquide receuilli servira à faire un autre flash en série. Ainsi
se déroule une distillation.
7. L'azéotropie: mélamge non idéaux
Lorsque les liaisons intermoléculaires ne sont pas du même ordre dans la solution (contrairement au mélange
idéal où, pour le mélange binaire A-B, les liaisons A-A, B-B, et A-B sont approximativemnet identiques, donc
ΔH de solubilisation = 0), deux cas se présentent:
* Pour une réaction avec ΔH > 0, c'est à dire une réaction endothermique, où la somme des énergies des
produits est supérieure à celle des réactifs (A-B > 2A-A), donc les liaisons moléculaires (A-A) sont moins
intenses que les liaisons intermoléculaires (A-B); le mélange est plus volatil (les molécules s'echapperont
plus facilement de la solution), la pression de vapeur augmente; en plus, la température diminue; la
volatilité est favorisée par une basse température.
* Pour une réaction exothermique, il se passe exactement le contraire.
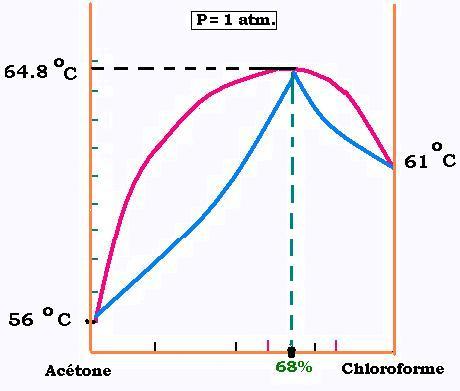
Ces différences par rapport à un mélange idéal, font que les courbes liquide-vapeur d'un
mélange de ce type se déforment. les températues d'ébullition de ces mélanges ne se situent
plus entre celles des deux constituants. Elles présentent des extréma (maximum ou minimum selon
le ΔH de la réaction). Ce phénomène est appelé azéotropie. À une pression fixée, le point
qui correspond à un extrémum de la coube d'ébullition d'un mélange binaire définie le pourcentage molaire et
la température d'ébullition de cette solution azéotrope.
L'azéotrope est un mélange qui se comporte comme
un liquide pur de même composition que sa vapeur à la température d'ébullition du mélange.
8. Applications
1.
On mélange du butane (nC4) avec du pentane (nC5) de fraction molaire respectives
χ4= 0.35 et χ5 = 0.65. On désire connaitre leur pourcentage en volume dans le mélange
à une température fixée.
nC4: Masse molaire: M4 = 58 g/mol, masse volumique: ρ4 585 kg/m3
nC5: Masse molaire: M5 = 72 g/mol, masse volumique: ρ5 650 kg/m3
V4/V = n4M4/ρ4/V = n4M4/ρ4/(n4M4/ρ4 + n5M5/ρ5)=
1/[1 + (n5M5/ρ5)/(n4M5/ρ4)] = 1/[1 + (n5M5ρ4/ρ5n4M4/)] =
1/[1 + (χ5 M5ρ4/ρ5 χ4M4/)]
= 1/[1 + (0.65 x 72 x 585 /650 x 0.35 x 58] = 32.5%
Donc:
V5/V = 67.5%
2.
Dans un cylindre, à 20 oC, on fait un mélange de 450 kg de propane
C3H8 à 30% et de 525 kg
de butane C4H10 à 70%.
on veut savoir leur fractions molaires respectives dans le mélange liquide,
leur pression de vapeur saturante, leur pression totale dans le mélange
gazeux et leur fractions molaires dans la vapeur.
Soient:
NA = Nombre de moles de A, NB = Nombre de moles de B
MA = Masse molaire de A, MB = Masse molaire de B
mA = Masse de A, mB = Masse de B
N = Nombre de moles totale dans le mélange = NA + NB
Dans le liquide:
χA = NA/N
NA = mA/MA
Donc:
χA = mA/MA/[mA/MA + mB/MB]
= 1/[1 + (mBMA /mAMB]
χA = 1/[1 + (525 x 44/450 x 58)] = 53%
χB = 1 - 53% = 47%
Le graphique donne les pressions de vapeur saturantes des
constituabts à l'état pur, à 20 oC:
P(butane) = 2 atm
P(propane) = 8 atm
P (totale) = 2 + 8 = 10 atm
Pressions partielles:
PA = χA P(butane) = 53% x 2 = 1.06 atm
PB = χB P(propane) = 47% x 8 = 3.76 atm
Pression totale P:
P = PA + PB = 1.06 + 3.76 = 4.82 atm
Fractions molaires gazeuzes:
γA = PA /P = 1.06/ 4.82 = 22%
γB = PB /P = 3.76/4.82 = 78%
|