Baccalauréats
Physique - Chimie
2013
Amérique du Nord
2017
Amérique du Nord
2009
Amérique du Nord
2011
Amérique du Nord
2013
Métropole
2015
Pondichery
2008
Amérique du Nord
© The scientific sentence. 2010

|
Physique - Chimie :
Les baccalauréats
Bac S 2013 Amérique du nord
Bac S - Physique - Chimie -
2013
Amérique du nord
EXERCICE I :
ASPIRINE ET PRÉVENTION CARDIOVASCULAIRE
L’une des propriétés pharmacologiques de l’aspirine est d’être un fluidifiant du sang.
C’est pourquoi l’aspirine peut être utilisée de manière préventive pour diminuer le
risque de formation de caillots sanguins responsables des accidents vasculaires cérébraux (AVC).
L’aspirine est alors prescrite à faible dose : 75 à 150 mg/jour.
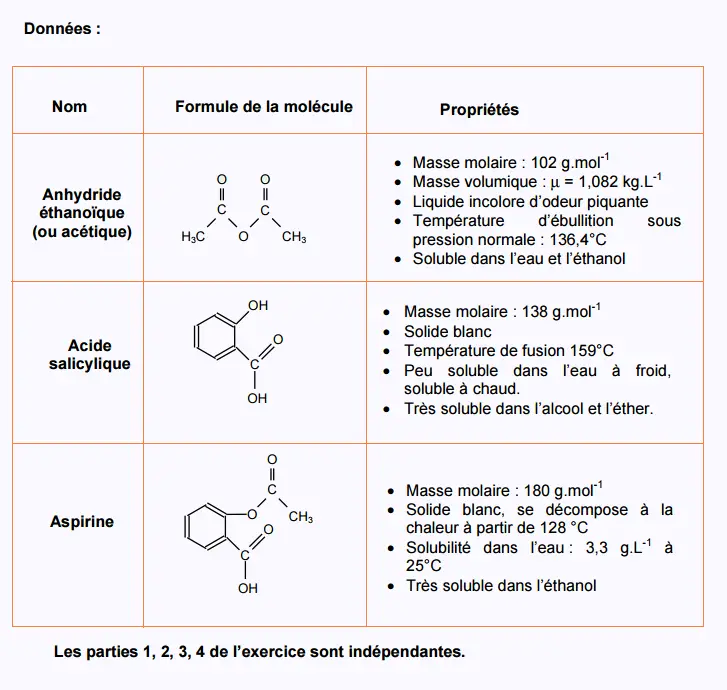
1. Synthèse de l’aspirine:
L’aspirine peut être synthétisée à partir d’acide salicylique et
d’anhydride éthanoïque .
L’équation de la réaction est :
La chromatographie sur couche mince (CCM) est l’une des techniques
qui permet de contrôler la réaction chimique.
Protocole :
• Préparer un bain marie à la température de 70 °C ;
• Dans un erlenmeyer, bien sec, sous hotte, introduire :
- 10,0 g d’acide salicylique ;
- 14,0 mL d’anhydride éthanoïque ;
- quelques grains de pierre ponce.
• Réaliser un premier prélèvement du milieu réactionnel en vue
d’une analyse sur CCM ;
• Adapter un réfrigérant à air sur l’erlenmeyer ;
• À la date t = 0, placer l’erlenmeyer dans le bain-marie ;
• Laisser réagir pendant une vingtaine de minutes tout en
réalisant quatre nouveaux prélèvements du milieu réactionnel
toutes les quatre minutes.
1.1. Obtention de l’aspirine :
1.1.1. Montrer que l’anhydride éthanoïque est introduit en excès.
1.1.2. Calculer la masse attendue d’aspirine lors de cette synthèse.
1.2. Suivi par chromatographie :
1.2.1. Proposer un protocole expérimental pour réaliser les différentes chromatographies
afin, notamment, de s’assurer de la formation de l’aspirine. La liste du matériel et des
produits disponibles est proposée dans le document 1 ci-dessous.
Document 1 :
matériel disponible pour effectuer la chromatographie.
Plaques pour CCM – capillaires – éluant – cuve à chromatographie – aspirine pur du commerce
dissous dans un solvant – acide salicylique pur dissous dans un solvant – lampe UV ou solution
de permanganate de potassium.
1.2.2. Quelles particularités doit présenter le chromatogramme obtenu avec le dernier
prélèvement, en admettant que le système réactionnel est alors dans son état final ?
2. Analyse spectrale des espèces chimiques intervenant dans la synthèse de l’aspirine
2.1. Spectre RMN de la molécule d’aspirine.
2.1.1. Recopier la formule de la molécule d’aspirine et identifier les deux groupes
caractéristiques dans cette molécule. Les nommer.
2.1.2. Deux carbone particuliers sont repérés par les lettres « a » et « b » dans la formule
de la molécule d’aspirine reproduite ci-dessous :
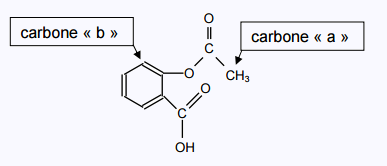
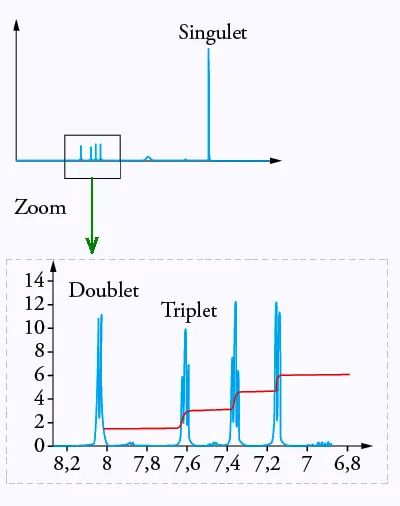
Expliquer pourquoi les atomes d’hydrogène liés au carbone « a » correspondent au singulet
du spectre RMN de la molécule d’aspirine reproduit dans le document 2 ci-après.
Justifier de même que le doublet de ce spectre RMN correspond à l’atome d’hydrogène lié
au carbone « b »
Document 2 :
spectre RMN de la molécule d’aspirine
2.2. Spectre IR de la molécule d’acide éthanoïque.
L’autre produit issu de la synthèse de l’aspirine est l’acide éthanoïque de formule brute
C2H4O2.
2.2.1. Donner la formule semi-développée de l’acide éthanoïque et du méthanoate de
méthyle qui est un isomère de l’acide éthanoïque.
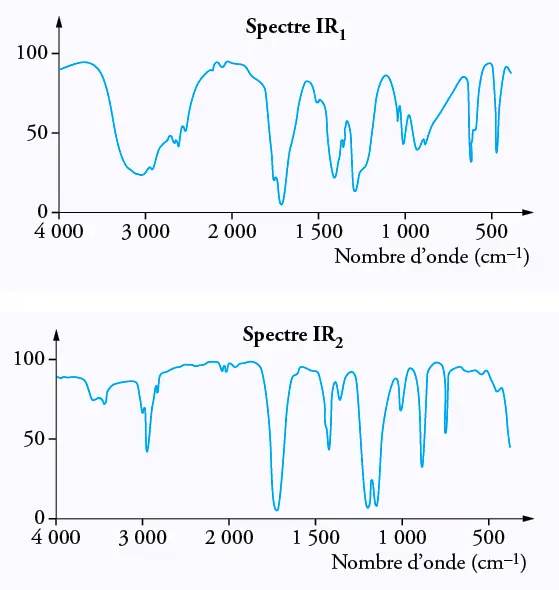
2.2.2. Les spectres infrarouges de ces deux espèces chimiques sont regroupés dans le
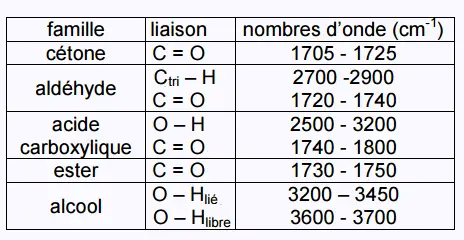
document 3 ci-dessous. Une table de données de spectroscopie infrarouge est également
fournie (document 4).
Identifier celui qui appartient à l’acide éthanoïque en justifiant.
Document 3 : spectres IR de l’acide éthanoïque et du méthanoate de méthyle.
Document 4 : table de données pour la spectroscopie IR.
3. Dosage d’un sachet d’aspirine
L’étiquette d’un sachet d’aspirine prescrit au titre de
la prévention des AVC porte la mention :
«Teneur en aspirine : 100 mg»
Un élève se propose de vérifier la teneur en aspirine, notée HA, de ce sachet.
Pour cela, il prépare une solution S en introduisant l’aspirine contenue dans le sachet dans une
fiole jaugée, puis en ajoutant de l’eau distillée pour obtenir une solution de volume 500.0 mL.
Il prélève ensuite un volume VA = (100.0 ± 0.1) mL de cette solution S qu’il dose avec une
solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration molaire
cB = (1.00 ± 0.02) x 10-2 moL.L-1 en présence de phénolphtaléine. Le volume VE de solution
aqueuse d’hydroxyde de sodium versé pour atteindre l’équivalence est VE = 10.7 ± 0.1 mL.
3.1. Écrire l’équation de la réaction acido-basique support de ce dosage.
3.2. Déterminer la masse mexp d’aspirine ainsi déterminée.
3.3. Déterminer l’incertitude relative Δmexp / mexp
dont on admet que, dans les conditions de
l’expérience, la valeur est donnée par la relation :
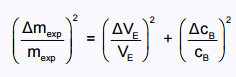
En déduire un encadrement de la masse mexp obtenue par l’élève.
3.4. L’encadrement obtenu à la question précédente est-il en accord avec la mention portée sur le
sachet d’aspirine ? Proposer une explication à l’écart éventuellement observé.
4. Autre forme de l’aspirine, moins agressive pour l’estomac
L’aspirine ou (acide acétylsalicylique) possède une base conjuguée, l’ion acétylsalicylate. Le pKa
du couple acide/base ainsi constitué est égal à 3,5.
4.1. Lors de la digestion, le pH de l’estomac est voisin de 2. Quelle est la forme prédominante du
couple aspirine/ion acétylsalicylate dans l’estomac ?
Justifier.
4.2. Quand l’aspirine reste trop longtemps sous cette forme prédominante dans l’estomac, elle y
provoque des lésions gastriques. C’est pourquoi on trouve dans le commerce des formulations
différentes, moins agressives pour la paroi de l’estomac, comme la catalgine.
Catalgine (acétylsalicylate de sodium)
- Le médicament est soluble dans l’eau et l’ingestion est facilitée.
- Dans l’estomac, dont le pH est très acide, les ions acétylsalicylate
réagissent avec lesions H3O+ pour redonner de l’aspirine moléculaire qui précipite. Ce précipité, obtenu
sous forme de grains microscopiques, est plus facilement assimilable.
4.2.1. Écrire la formule semi-développée de l’ion acétylsalicylate.
4.2.2. Expliquer pourquoi la catalgine est soluble dans l’eau.
4.2.3. Donner l’équation de la réaction se produisant dans l’estomac après ingestion de la
catalgine.
|
|