Baccalauréats
Physique - Chimie
2013
Amérique du Nord
2017
Amérique du Nord
2009
Amérique du Nord
2011
Amérique du Nord
2013
Métropole
2015
Pondichery
2008
Amérique du Nord
© The scientific sentence. 2010

|
Physique - Chimie :
Les baccalauréats
Bac S 2017 Amérique du nord corrigé
Corrigé du bac Physique - Chimie
S 2017 Amérique du nord
EXERCICE II :
LES SCIENCES AU SERVICE DE LA
PERFORMANCE SPORTIVE (10 points)
Partie 1 : Calcul des puissances
développées par les cyclistes
1. Questions préliminaires
1.1. Les mesures sont effectuées dans un référentiel terrestre
comme par exemple le bord de la route.
1.2. Le cycliste a parcouru d = 10.4 km en une durée Δt =
31 min 51 s = 31 x 60 + 51 s = 1911 s = 1911/3600 h.
v = d /Δt = 10.4/(1911/3600) = 19.6 km/h, comme indiqué.
1.3. Énergie mécanique Em = EPP + EC
EPP = m.g.z , Énergie potentielle de pesanteur
avec z altitude définie par rapport à une référence
à préciser.
EC = (1/2) m v2 , Énergie cinétique
Lors de l’ascension à vitesse constante, l’énergie cinétique ne
varie pas tandis que l’énergie potentielle de pesanteur augmente
en raison de l’élévation d’altitude.
Ainsi l’énergie mécanique augmente au cours de l’ascension.
2. Étude de l’ascension du col par le cycliste et validation
du modèle de calcul de puissances
2.1. ΔEPP = EPP B – EPP A
ΔEPP = m.g.ZB – m.g.ZA = m.g.(ZB – ZA)
ΔEPP = 67.8 x 9.8 x ( 1564 – 759 )
ΔEPP = 5.3 x 105 J, comme indiqué.
2.2. ΔE = P.Δt donc
Pasc =ΔE/Δt
Pasc = 5.3 105/1911 = 2.8 x 102 W
Sur
le graphique 1, on constate que l’ordonnée du point
d’abscisse v = 19.6 km.h-1 est
effectivement proche de cette valeur.
Effectuons une vérification rigoureuse :
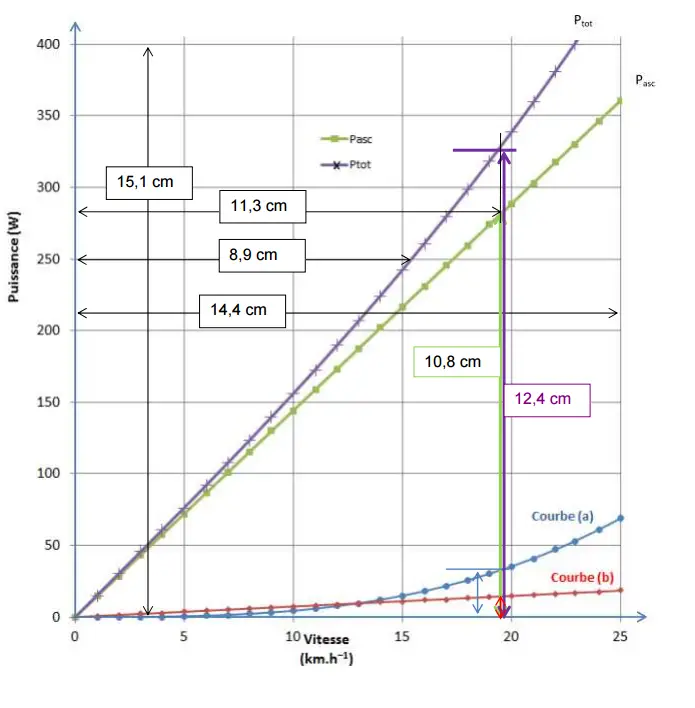
Déterminons l’échelle horizontale pour les vitesses :
14.4 cm  25 km.h-1 25 km.h-1
x cm  19.6 km.h-1 19.6 km.h-1
D'où: x = 19.6 x 14.4/25 = 11.3 cm
Cherchons la puissance Pasc :
15.1 cm  400 W 400 W
10.8 cm  Pasc Pasc
D'où: Pasc = 400 x 10.8/15.1 = 286 W
Soit avec deux chiffres significatifs
Pasc = 2.9 x 102 W,
très proche de la valeur calculée.
2.3. Il est indiqué que Proulement est proportionnelle
à la vitesse du cycliste. Ainsi la courbe
représentative de la Proulement en fonction de v doit
avoir l’allure d’une droite passant par l’origine.
C’est ce que montre la courbe (b).
Il est également indiqué que Pair est proportionnelle
au cube de la vitesse, ce qui correspond à la
courbe (a).
Avec la courbe (b), on détermine graphiquement Proulement:
15.1 cm 400 W 400 W
0.7 cm  Proulement Proulement
D'où:
Proulement = 400 x 0.7/15.1 = 19 W
Avec la courbe (a), on détermine Pair
15.1 cm  400 W 400 W
1.2 cm  Pair Pair
D'où:
Pair = 400 x 1.2/15.1 = 32 W
2.4. On détermine graphiquement Ptot
15.1 cm  400 W 400 W
12.4 cm  Ptot Ptot
Ptot = 400 x 12.4/15.1 = 328 W
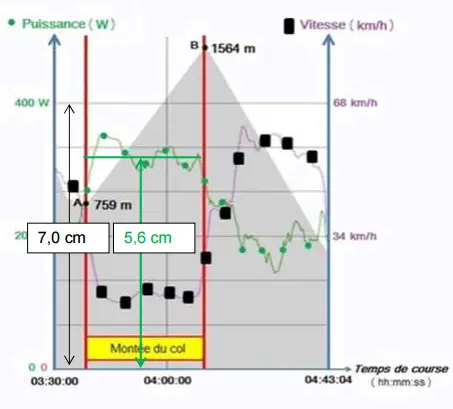
Sur le document 1, on procède
encore au même raisonnement.
7.0 cm  400 W
5.6 cm 400 W
5.6 cm  Ptot-SRM Ptot-SRM
Ptot-SRM = 400 x 5.6/7.0
= 3.2 x 102
Le modèle est validé.
La détermination de Ptot-SRM a été un peu
approximative.
3.Prédiction de performances à partir du modèle
On exploite à nouveau le graphique 1 pour
déterminer la vitesse qui correspond à la puissance
de 250 W.
14.4 cm  25 km.h-1
8.9 cm 25 km.h-1
8.9 cm  v v
v = (25 x 8.9)/14.4 = 15.4 km.h-1.
v = d/Δt. Donc Δt = d/v =
10.4/15.4 = 0.673 h = 40.4 min
Il faudra environ 40 minutes au cycliste
amateur pour réaliser la montée du col.
Partie 2 : Étude de la physiologie de
l’effort et régulation du pH sanguin
1. L’acide lactique C3H6O3
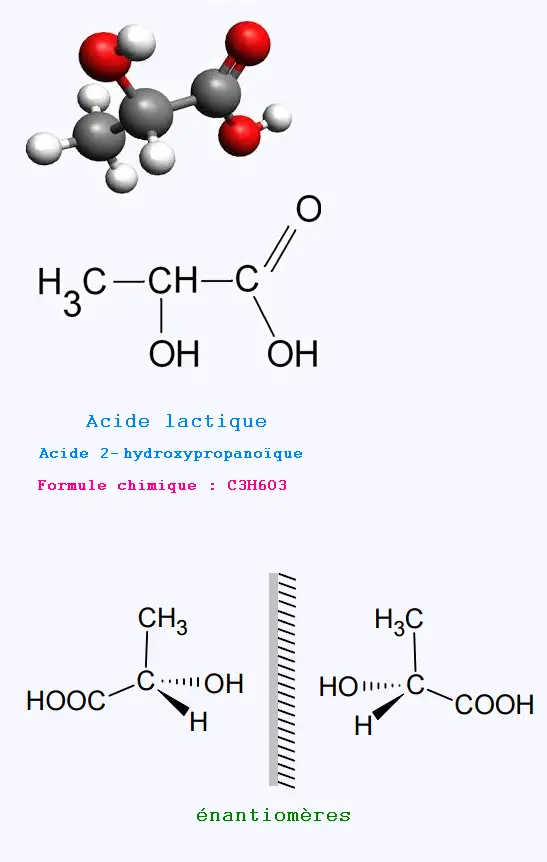
1.1. L’acide lactique possède un groupe carboxyle
COOH associé à la famille des acides
carboxyliques et un groupe hydroxyle OH associé à la
famille des alcools.
1.2. La molécule d’acide lactique possède un seul atome de
carbone asymétrique. C’est une
molécule chirale qui possède donc deux stéréoisomères images
l’un de l’autre dans un miroir
plan et non superposables. Ce sont des énantiomères.
Un objet ou un système est appelé chiral s’il constitue
l’image miroir d’un autre objet
ou système avec lequel il ne se confond pas.
2. Influence de la production d’acide lactique sur le pH sanguin
2.1. Pour trouver la formule de l’ion lactate, il faut enlever un
proton H+
à la formule de l’acide lactique (par définition d’un
couple acide/base). On enlève le proton H+
appartenant au
groupe carboxyle COOH associé à la famille des acides
carboxyliques.
Les atomes d’oxygène respectent la règle de l’octet,
ils sont entourés de 4 doublets (liants ou non liants).
2.2. Réaction de l’acide lactique
AH avec l’eau :
Réaction (1) :
AH + H2O  A- + H3O+
A- + H3O+
Remarque : comme les acides carboxyliques sont des acides faibles,
leur réaction avec l’eau est limitée d’où la double flèche
 dans l’équation de la réaction.
dans l’équation de la réaction.
2.3. D’après l’équation de la réaction (1), il se forme autant d’ions
oxonium que d’ions lactate.
2.4. Lorsque le seuil lactique est atteint, on a
[A–] = 3.0 x 10-3 mol.L–1.
[H3O+] = [A- ]
pH = – log[H3O+] = – log (3.0 x 10-3) = 2.5.
Lors d’un effort, en l’absence de régulation, le pH chuterait donc à la valeur
de 2.5. Cette valeur
est si faible qu’elle n’est pas compatible avec la vie.
3. Régulation du pH sanguin
3.1. L’acide lactique réagit avec la base
hydrogénocarbonate aussi appelée bicarbonate.
Réaction (2)
AH + HCO3-  A-
+ H2CO3 A-
+ H2CO3
« le taux de lactate dans le sang s’accroît alors que le
taux de bicarbonate plasmique baisse »
En effet les ions lactate sont des produits, leur concentration augmente
tandis que les ions bicarbonate HCO3-
sont des réactifs alors leur concentration diminue.
3.2. Lorsque le seuil lactique est atteint la concentration
en ions lactate vaut
[A–] = 3.0 x 10-3 mol.L-1
Pour 1 L, il s’est formé 3.0 x 10-3 mol de A-
et d’après l’équation de la réaction (2)
il s’est également formé 3.0 × 10-3 mol.L-1 de H2CO3.
Par ailleurs, les données indiquent que la concentration
dans le sang valait initialement
[H2CO3]0 = 0.9 mmol.L-1 = 0.9 x 10-3 mol.L-1.
Là encore, si l’on raisonne pour 1 L, il y avait déjà
0.9 x 10-3 mol de H2CO3 par litre sang et
s’ajoute 3.0 x 10-3 mol.
1 L de sang contient donc 0.9 x 10-3 + 3,0 x 10-3
= 3.9 x 10-3mol.
On retrouve bien [H2CO3]f = 3.9 mmol.L
3.3. D’après les données, la concentration
en ions hydrogénocarbonate (= bicarbonate) dans le
sang vaut [HCO3–] = 25 mmol.L-1 et le texte en début de
partie 2 indique que cette concentration
baisse.
La réaction 2 permet de dire que s’il s’est formé 3.0 mmol par
litre de H2CO3 , c’est que 3.0 mmol de HCO3– ont été consommée.
Pour 1 L, il reste 25 – 3.0 = 22 mmol de HCO3–.
Donc [HCO3–]f = 22 mmol.L–1.
On
peut calculer le rapport [HCO3-]f/[H2CO3]f = 22/3.9 = 5.6
comme indiqué.
On peut alors calculer le pH du sang au seuil lactique si la
réaction (2) assurait seule la régulation du pH de l’organisme.
pH = 6.1 + log ([HCO3-]f/[H2CO3]f) = 6.1 + log(5.6) = 6.8 < 7.0.
Cette valeur est trop basse par rapport aux valeurs limites
compatibles avec la vie indiquées dans les données.
3.4. Il est indiqué que le pH sanguin vaut 7.4 or le
système « tampon bicarbonate » seul permet
d’obtenir un pH de 6.8. D’autres systèmes tampons permettent
forcément de compenser cette différence de pH.
3.5. Les poumons peuvent évacuer plus de dioxyde de carbone
par la respiration (hyperventilation) et donc, cela fait
diminuer la concentration en H2CO3 et augmenter le pH,
pour le rendre compatible avec la vie.
|
|