Articles divers
© The scientific sentence. 2010

| |
|
Articles
Sciences
Le princpe d'exlusion de Pauli
Le principe d'exlusion de Pauli
Vers la Chimie Quantique
Dans un atome, il y a un noyau et des électrons. Les électrons sont présents autour du noyau dans des régions bien spécifiques appelées orbitales atomiques. Chaque orbitale ne peut contenir que deux électrons au maximum.
Un électron dans un atome est décrit avec trois nombres quantiques: n, l, et ml. Mais pour que cette description soit complète, le physicien Wolfgang Ernst Pauli introduisait , en 1924, le nombre de spin ms pour l'électron. Ainsi, chaque électron dans un atome possède une seule et unique identité complètement définie par ces quatre nombres.
n , le nombre quantique principal ; ℓ , le nombre quantique azimutal ; mℓ , le nombre quantique magnétique ; et ms , le nombre quantique de spin +1/2 et -1/2.
Exemple:
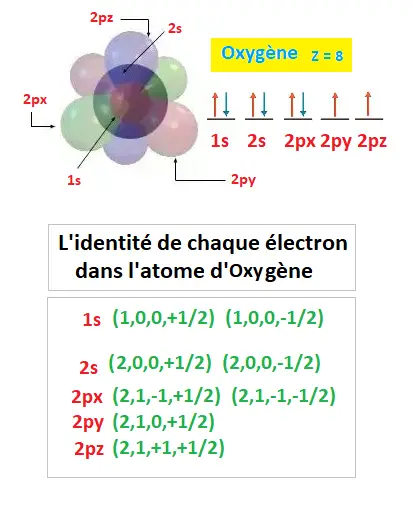
L'atome d'oxygène possède 8 électrons. Il a 2 èlectrons sur sa première orbitale (1s) qui est une couche et 6 répartis sur 4 orbitales qui sont des sous-couches(2s, 2p).
L'introduction du concept du spin par Pauli découle directement de son principe, dit principe d'exclusion
de Pauli. Ce principe affirme que :
Deux électrons d’un même atome ne peuvent pas avoir le même ensemble de quatre nombres quantiques.
 Wolfgang Ernst Pauli est un physicien autrichien . Il est né le 25 avril 1900 à Vienne
et mort le 15 décembre 1958 à Zurich, en Suisse. Ses travaux en Mécanique Quantique, incluant
son principe d'exclusion, ou principe de Pauli, lui ont valu le prix Nobel de physique de 1945.
Wolfgang Ernst Pauli est un physicien autrichien . Il est né le 25 avril 1900 à Vienne
et mort le 15 décembre 1958 à Zurich, en Suisse. Ses travaux en Mécanique Quantique, incluant
son principe d'exclusion, ou principe de Pauli, lui ont valu le prix Nobel de physique de 1945.
-- Abdurrazzak Ajaja
Novembre 2014
|
|