Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Absorption
I. Definitions:
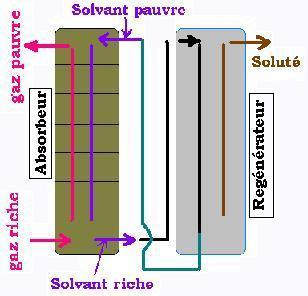
Le procédé d'absorption implique la séparation d'un mélange gazeux par un solvant liquide. Le procédé inverse
c'est à dire extraire le gaz d'un liquide est appelé strippage. le but du procédé d'absorption est de transferer
le soluté contenu dans un gaz vers un solvant liquide. Il s'agit soit de purifier un gaz de certains constituants indésirables,
soit de récuperer un gaz désiré du mlange. Le gaz à traiter est dit gaz riche, la charge dépourvue du soluté visé est
dite gaz pauvre. le solvant est dit pauvre lorsqu'il est pur et riche lorsqu'il transporte le soluté extrait de la charge.
Le contact est réalisé dans une colonne à plateaux ou à garnissage, appelé absorbeur. Le solvant pauvre
est introduit en tête de colonne et descend à contre courant du gaz riche qui remonte la colonne.
Le solvant riche en soluté est alors transféré vers le regénérateur pour extrarire le soluté et par la suite réingecter
le solvant redevenu pur en tête de l'absorbeur du solvant. Ainsi on réalise un procédé continu.
Sur chaque plateau "j" de la colonne de l'absorbeur, le solvant et le soluté sont mélangés
intimement; le soluté est extrait du mélange gaz riche. Lorsque le liquide est
saturé avec le gaz, l'équilibre est atteint; ainsi pour chaque plateau "j", le coefficient
d'équilibre pour le soluté "A" s'ecrit:
ΚA,j = yA,j/xA,j
yA,j est la fraction molaire du soluté A dans le gaz riche au plateau j
xA,j est la fraction molaire du soluté A dans le solvant au plateau j.
Nous savons que le coefficient d'équilibre dépend de la pression et
de la température. Ces deus dernières grandeurs changent le long de
la colonne; ainsi le coefficient d'équilibre varie le long de la colonne.
En absorption, les fractions molaires utilisées sont celles du souluté à l'entrée
et à la sortie de l'absorbeur; ainsi le coefficient d'equilibre utilisé prend
une valeure moyenne ΚA pour le solvant A.
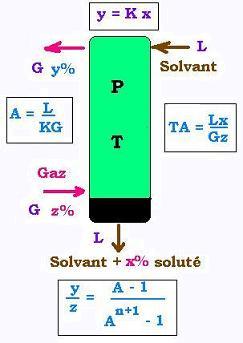
On défini le facteur d'absorption A comme le rapport du débit molaire
d'extrait (L) en soluté et le débit molaire de raffinat (G) en soluté, soit
A = xL/Gy = L/KG.
A = xL/Gy = L/KG
A: Facteur d'absorption,
L: débit du solvant en kmol/hr,
G: débit du gaz en kmol/hr,
K: Constante d'équilibre moyenne à une pression et température determinées.
On défini aussi le taux d'absorption TA comme le le rapport du débit molaire
d'extrait (L) en soluté et le débit molaire de la charge(G) en soluté, soit
TA = xL/Gz = (y/z) L/KG = 1 - (y/z).
TA = xL/Gz = (y/z) L/KG = 1 - (y/z)
y/z = (A - 1)/(An+1 - 1)
La quantité y/z est aussi donnée par l'abaque de Kremser.
Pour le bilan matière de la colonne en soluté, nous supposons, à travers l'absorbeur,
que la concentration en soluté dans le gaz est faible de
telle sorte que le débit molaire du gaz riche G est égal à celui du gaz pauvre et
le débit molaire du solvant pauvre L est égal au débit molaire du solvant riche.
Si z est la pourcentage molaire du soluté dans le gaz riche à traiter et x celle dans solvant riche
à la sortie de l'absorbeur, et y celle dans le gaz pauvre débarassé du soluté, on aura:
z G = y G + x L
II. Absorption de plusieurs solutés
Il peut arriver que l'on veut extraire plusieurs solutés du mélange gazeux de
la charge. Si la composition de la charge de débit molaire G (kmol/hr) à l'entrée de l'extracteur
en solutés est de: z1, z2, z3, ..., zn et que l'on
veut extraire quelques solutés de compositions zi, on procède de la même façon que
pour un seul soluté pour chaque soluté constituant du mélange gazeux. Nous aurons donc pour
chaque soluté visé zi, yi et xi. Donc pour chaque soluté, nous
aurons un coefficient d'équilibre Ki = yi/xi, un facteur d'absorption
Ai = L/GKiet un taux d'absorption (TA)i = 1 - (yi/zi).
Les coefficients d'équilibre sont tabulés ou donnés en abaque. L'abaque de Scheibel & Jenny donne
ces constantes d'équilibre pour 18 hydrocarbures en traçant un simpe trait entre une température
et une pression données.
Exemple:
On veut extraire du méthane, de l'éthane et de l'éthylène d'un mélange d'hydrocarbure gazeux entrant
une colonne d'absorption de 8 étages à une température de 10 oC et une pression de 20 atm.
Les concentrations molaires des trois solutés sont égales (zméthane = zéthane
= zéthylène = z) = 0.5% mol. Le débit molaire du gaz est G = 90 kmol/hr et celuit du solvant
liquide est L = 140 kmol/hr. L'analyse du gaz pauvre à la sortie de l'éxtracteur nous renseigne sur
sa teneur en solutés absorbés par un solvant.
L'abaque de Scheibel & Jenny donne pour le méthane, l'éthane et l'éthylène à 10 oC et
20 atm: Kméthane = 7.5, Kéthane = 1.9 et Kéthylène = 1.4. d'où
Améthane = 140/7.5 x 90 = 0.21 , Aéthane = 140/1.9 x 90 = 0.82 et
Aéthylène = 140/1.4 x 90 = 1.11.
Pour 8 plateaux dans la colonne, l'abaque de Kremser donne pour chaque facteur d'absorption Ai
le taux d'absorption correspondant (TA)i. Nous avons:
(TA)méthane = 0.21, (TA)éthane = 0.78 et (TA)éthylène = 0.93.
Les (y/z) correspondants donne le y cherchées:
yméthane = 0.5% (1 - 0.21) = 0.40%, yéthane = 0.5% (1 - 0.78) = 0.11%, et
yéthylène = 0.5% (1 - 0.93) = 0.04%.
III. Absorption: Lavage aux amines
III.1. Le procédé
Une amine est un composé organique contenant l'azote (N) comme atome de base avec un radical
hydrocarboné (R). Elle se presente sous forme primaire: N-H-H-R, ou secondaire N-H-R-R,
ou tertiare: N-R-R-R. La diéthanolamine DEA de formule brute NH(CH2CH2OH)2 est une amine secondaire
qui possède une affinité pour l'hydrogène sulfuré H2S et pour le dioxyde de carbone CO2.
Cette propriété est utilisée pour laver ou épurer à l'amine un gaz d'hydrocarbures des constituants
acides H2S et du CO2 qu'il contient.
Dans ce qui suit, nous étudierons le lavage d'un gaz d'hydrocarbures contenat de l'hydrogène sulfuré
visé comme soluté à éliminer, en utilisant comme solvant une solution aqueuse d'amine DEA.
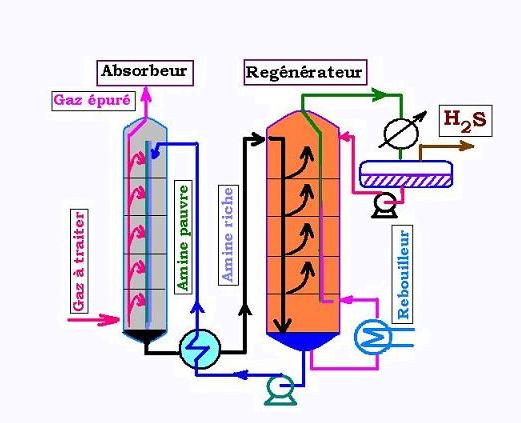
Le procédé est le suivant: On injecte, en bas de colonne de l'absorbeur, le gaz riche d'hydrocarbures contenant
le soluté H2S et des Cn. L'amine pauvre comme solvant descend la colone à contre-courant et absorbe le H2S à travers les plateaux
de la colonne. On obtient en haut de colonne un gaz pauvre en H2S, et en bas de colonne une amine riche en H2S.
Celle-ci traverse d'abord un échangeur de chaleur côté calandre, et se rechauffe d'avantage. Elle arrive au regénérateur
et descend à contre-courant d'une vapeur d'eau générée par un rebouilleur. L'amine riche s'appauvri en H2S, traverse
l'echageur côté tube, se refroidi et retourne à l'absorbeur comme solvant pur. La vapeur d'eau chargée en H2S sort du
regénérateur par le haut de colonne. Une fois condensée et passée au ballon de reflux, l'eau liquide revient au regénérateur et le l'hydrogène sulfuré H2S , toujours gazeux, est receuilli dans une unité de soufre comme un distillat. Dans l'absorbeur, le soluté H2S est
absorbé par l'amine; dans le regénérateur, le soluté est désorbé de l'amine par strippage.
III.2. Les paramètres de contrôle du procédé
1. Dans l'absorbeur:
1.1. Température:
La charge à traiter, contenant le soluté H2S, du dihydrogène H2 et l'ensemble des
alkanes de C1 à C5, à l'entrée de l'absorbeur, doit être à une température supérieure à la
température d'ebullition la plus grande parmis celles des constituants dans le but de rester en
phase gazeuze. 40 oC pour le groupe H2S-H2-Cn est raisonnable à pression atmosphérique. En
effet, la table suivante donne les températures d'ébullition des cinq premiers alcanes à 1 atmosphère:
| Formule brute | Nom | Point d'ébullition en oC |
| CH4 | Méthane | - 161 |
| CH3CH3 | Éthane | - 89 |
| CH3CH2CH3 | Propane | - 42 |
| CH3CH2CH2CH3 | Butane | - 0.5 |
| CH3CH2CH2CH2CH3 | Pentane | + 36 |
Le long de la colonne, la température augmente de haut en bas; cela est du au fait
que l'absorption est un phénomène exothermique. Ainsi, d'après le principe de Le Chatelier,
cette exothermicité est favorisée à basse température. Cependant, comme la température est limitée
à partir du bas de colonne à l'entrée du gaz (40 oC), une température du même ordre en
haut de colonne est raisonnable (40 + 10 = 50 oC).
En bas de colonne, la température du solvant riche est supérieure à celle de l'entrée (60 oC).
1.2. Pression:
Selon le principe de Le Chatelier, l'absorption est favorisée à haute pression; sans pour autant
diminuer de la tension de vapeur du gaz, c'est à dire se volatilité. Ainsi une pression
de 5 bars pourrait être maintenue constante dans toute la colonne (en négligeant les pertes de charges dues à
la présence des plateaux).
On note enfin que le facteur d'absorption A = L/KG montre que l'absorption est favorisée lorsque:
- K est faible, donc haute pression et basse température (voir aussi l'abaque de Scheibel & Jenny),
- Le rapport des débits molaires L(solvant)/G (gaz) est élevé.
On note aussi que dans l'absorbeur, la valeur de la pression et celle de la température déterminent
le coefficient d'équilibrepour relatif à chaque constituant du gaz.
2. Dans le regénérateur:
2.1. Température:
Contrairement à l'absorbeur, l'evaporation du soluté (H2S) est favorisée à haute température. Le rebouilleur
génère une vapeur surchauffée à une température élevée (120 oC). La vapeur et le gaz soluté en haut de colonne
se trouvent à une température approximativement du même ordre de grandeur (100 oC).
2.2. Pression:
Une basse pression favorise l'évaporation. Ainsi, la vapeur d'eau et le soluté gazeux H2S s'évare
facilement. Une pression de 1.6 bar en tête de colonne est correcte. Un volume plus grand en contenance
pour le générateur favorise aussi cette chutte de température.
|