Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
|
Chimie: Acides - bases
1. Définitions:
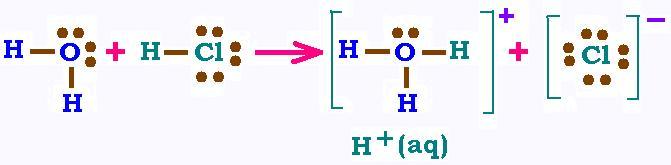
Si on l'on verse du chlorure d'hydrogène HCl dans l'eau, il se produit
une réaction chimique dite de dissociation. L'atome d'hydrogène est
un non-métal avec un électron de valence; le chlore est aussi un non-métal
avec 7 électrons de valence. Dans la molécule d'eau, l'atome d'oxygène, avec
ses 6 électrons de valence, possède deux doublets liants avec les deux
hydrogènes et deux doublets libres. Une fois le HCl dans l'eau,
l'oxygène de l'eau s'empare de l'hydrogène du HCl pour en faire une liaison
double au profit d'un électron qu'il cède au chlore. Ainsi la molécule d'eau
devient un ion positif (perdant un électron) H3O+, appelé
ion hydronium; le chlore devient un ion négatif (gagnant un électron).
La structure de Lewis explique cette situation.
Dans le cation hydronium H3O+, l'atome d'hydrogène est
dépourvu de son électron (pris par le chlore), c'est donc un proton attiré
par la molécule d'eau, donc hydraté. On comprend donc que H3O+ = H+(aq).
On ecrit donc la réaction suivante:
H2O (l) + HCl (g) → H3O+ (aq) + Cl+ (aq) : (1)
Une dilution est un ajout de solvant dans une solution afin de
diminuer la concentration d'un suluté. Dans ce mélange d'eau et de chlorure d'hydrogène,
il est supposé que le HCl est suffisament dilué; par conséquent, les molécules
d'eau qui entourent (qui hydratent) les protons H+ sont négligables devant
la quantité de molécules d'eau dans toute la solution. Ainsi, l'équation (1) doit s'ecrire
plutôt:
H2O (l) + HCl (g) → H3O+ + H2O (l)+ Cl+ (aq)
C'est à dire:
HCl (g) → H+ (aq) + Cl- (aq)
Toute substance qui se manifeste comme le chlorure d'hydrogène dans l'eau, c'est
à dire une substance qui libère un proton H+ est appelé un
acide. C'est la définition d'un acide donnée par le chimiste Arrhenius.
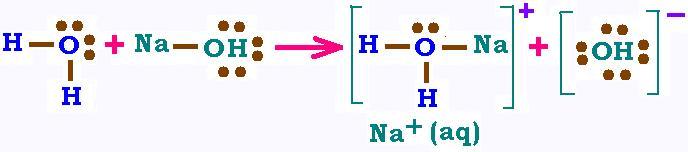
Si l'on verse maintenant de la soude dans l'eau, la molécule
NaOH vas libérer un ion OH -. On appelle base
une substance capable de libérer un ion hydroxyde OH -.
C'est aussi la définition d'une base selon la théorie d'Arrhenius qui, en fait,
reste limitée aux milieux aqueux.
La théorie des deux chimistes Bronsted et Lowry, plus générale,
défini un acide comme un donneur de protons et une base comme accepteur
de protons, valable aussi bien qu'en solutions aqueuses qu'en phases gazeuses.
Une troisième théorie, appelée théorie de Lewis, très génerale, donne les
définitions suivantes: un acide est un accepteur d'électrons et une
base est un donneur d'électrons.
2. Propriétés des acides et des bases:
Dans l'exemple de la dissociation du HCl, nous avons utilisé le fait que
la réaction est complète (quasiment à 100%). En fait, elle l'est puisque le chlorure
d'hydrogène HCl est un acide fort; c'est à dire un acide complètement
dissocié. La réaction inverse de formation de HCl à partir des ions H+
et CL- est insignifiante. C'est une caractéristique des acides forts
en milieu aqueux, dont les plus courants sont: l'acide chlorhydrique HCl,
l'acide sulfurique H2SO4, l'acide nitrique HNO3 et l'acide
pechlorique HCLO4.
Pour l'exemple de la soude, nous avons aussi une réaction complète puisque
cet hydroxyde de sodium NaOH est une base forte. Parmi les bases fortes, qui
sont en majorité des groupements hydroxyde, on compte la chaux Ca(OH)2,
l'hydroxyde de magnésium Mg(OH)2, l'hydroxyde de potassium KOH, la soude
caustique NaOH, et l'ion sulfure S2-.
Les acides faibles et les bases faibles ne sont pas
complètement dissociés en milieux aqueux. Ainsi leur équilibre est
plutôt très déplacé vers la gauche. Parmi les acides faibles, on cite l'acide
acétique CH3COOH, l'acide carbonique H2CO3, l'acide
sulfhydrique H2S et l'ion ammonium NH4+. Les bases
faibles comptent entre autres l'ammoniac NH3 et le bicarbonate de soude
NaHCO3.
Que se soit un acide fort ou faible ou une base forte ou faible, l'équilible
existe toujours. On le représente par la réaction générale suivante:
acide + base ↔ (base conjugée de l'acide) + (acide conjugué de la base)
La constante d'équilibre s'ecrit:
Ka =([acide conjugué] x [base conjugué])/([acide] x [base])
Exemples
HCl (acide) + H2O (base) ↔ Cl-(base conjuguée) + H3O+(acide conjugué)
NH3 (base) + H2O (acide) ↔ NH4+(acide conjugué) + OH-(base conjuguée)
Généralement:
HA(acide) + H2O (base) ↔ A-(base conjuguée) + H3O+(acide conjugué)
La constante d'équilibre pour un acide (a):
Ka =([A- ] x [H3O+ ])/([HA])
Pour un acide fort: [A- ] = [HA], et donc:
Ka = [H3O+ ]
BOH(base) + H2O (acide) ↔ B+(acide conjugué) + OH-(base conjuguée)
La constante d'équilibre pour une base (b):
Kb =([B+ ] x [OH- ])/([BOH])
Pour une base forte: [B+ ] = [BOH], et donc: Kb = [OH- ]
L'eau pure est un acide et une base à la fois. Une telle substance est dite amphotère ou ampholyte.
H2O (acide) + H2O (base) ↔ OH-(base conjuguée) + H3O+(acide conjugué)
La constante d'équilibre pour l'eau:
Ke =[OH- ] x [H3O+ ] = 10-7 x 10-7 = 10- 14
Remarque:
On peut constater qu'en équilibre, lorsqu'un acide est fort [HA] est faible, donc son Ka est grand et
inversement. De même, lorsqu'une base est forte [HB] est faible, donc son Kb est grand et inversement.
On se rappelle du principe de Le Chatelier suivant lequel une perturbation
d'un équilibre le fait réagir de manière à contrer l'effet de cette perturbation.
Ainsi, lorsqu'on ajoute un acide à l'eau, donc une augmentation des ions H3O+,
le système réagi à cette effet en favorisant la formation de l'eau (réaction inverse) en utilisant
les ions (OH)-. Dans ce cas [H3O+] augmente et [(OH)-]
diminue, mais le produit [H3O+][(OH)-] reste constant = 10- 14.
3. Neutralisation
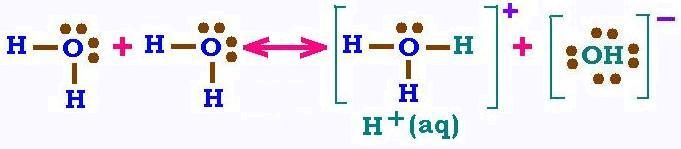
On se rappellle que dans l'eau pure en elle même existe toujours des réactions
chimiques en équilibre:
2 H2O ↔ H3O+ + (OH)-
L'eau pure est suffisament diluée pour pouvoir ecrire:
H2O + H2O ↔ H2O + H+(aq) + (OH)- (aq)
Ou tout simplement:
H2O ↔ H+(aq) + (OH)- (aq)
L'eau pure est neutre. Il ya autant d'ions H+ que d'ions
(OH)-. Expérimentalement, à 25 oC, [H+] = [(OH)-] = 10-7 moles/litre.
En tant que solvant, l'eau dissolve l'acide chlorhydrique HCl en ions H+
et Cl-. Elle dissolve aussi la base NaOH en Na+ et (OH)-.
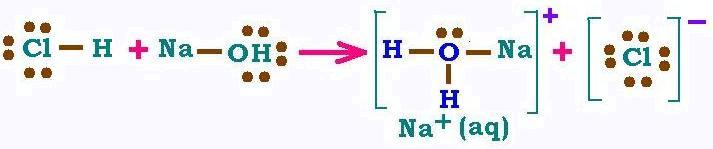
En milieu aqueux, le mélange d'un acide (HCl) et d'une base (NaOH) produit un sel selon
la réaction:
HCl + NaOH → NaCl + H2O. Ici, un proton est transféré
de l'acide vers la base. C'est la réaction de neutralisation.
Dans un milieu aqueux, acide + base = sel + eau
4. Le pH
Les constantes d'équilibre comportent souvent des valeurs très faibles, c'est
surtout le cas des acides faibles et des bases faibles (à 25 oC, pour l'ion ammonium NH4+,
Ka = 5.8 x 10- 10 mol/L; et pour l'ammoniac NH3,
Kb = 1.8 x 10- 5 mol/L). On défini donc une échelle simple en utilisant
l'opposé du logarithme décimal (à base 10) : "- log" . Ainsi, on défini le pH d'une solution
de la façon suivante:
pH = - log [H+]
Le pH est mesuré par un papier pH ou un pHmètre. Sa valeur n'a pas d'unité.
On sait qu'à 25 oC, [H+ ]= 10-7 pour l'eau pure qui est en fait neutre
puisqu'elle comporte autant de cations -7 que d'anions (OH)-). Donc:
pH (eau pure, à 25 oC) = 7
Par définition, une solution est neutre si son pH = 7, acide si son
pH < 7, basique si son pH est > 7.
On défini de même le pOH d'une solution comme:
pOH = - log [(OH)-]
Pour une solution acide, basique ou neutre, le produit [H3O+][(OH)-],
qui représente la constante d'équilibre Ke de l'eau est constant et est égal à 10- 14
à 25 oC. Ainsi:
Pour toute solution à 25 oC: pH + pOH = 14
Pour des raisons pratiques, on défini aussi les relations suivantes:
pKa = - log Ka et pKb = - log Kb
Caractéristiques des forces des acides
1.
Pour un acide fort, d'équation:
HA ↔ H+ + A-, où: [A-] = [H+]= [HA], on a
Ka = [H3O+ ], donc:
Pour un acide fort, pKa = pH
2.
Pour une base forte, d'équation:
BOH ↔ B+ + (OH)-, où: [B+] = [(OH)-] = [BOH], on a
Kb = [OH- ],donc:
Pour une base forte, pKb = pOH
3.
Pour un acide faible, la dissociation est négligeable. Si [ε] représente les
concentrations des ions formées [H3O+ ] et [A-], qui
sont égales, negligeables devant la concentration Ca = [HA] de l'acide, on peut ecrire
à l'équilibre:
Ka = [ε] x [ε] / [HA - ε] = [ε]2 / [HA]
D'où:
[ε]2 = [H3O+ ]2 = Ka x Ca
Et donc:
Pour un acide faible, [H3O+ ] = [Ka Ca]1/2
4.
Le même raisonnement conduit à:
Pour une base faible, [(OH)- ] = [Kb Cb]1/2
5. Titrage
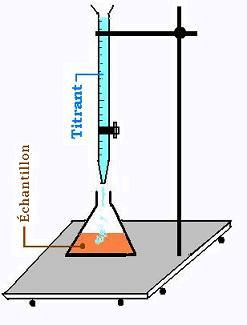
Titrer une solution, c'est y verser sa solution conjuguée pour
la ramener à une solution neutre. L'allure d'une courbe pH en fonction
du volume titrant permet de rendre compte de la progression du
titrage.
Si l'on considère le titrage d'un volume VHCl d'HCl de concentration
inconnue CHCl par NaOH de concentration connue CNaOH, nous
aurons l'équilibre suivant:
HCl + NaOH ↔ NaCL + H2O
Donc une mole d'HCl est requise pour neutraliser une mole de
NaOH. Au moment de la neutralisation, le nombre de moles d'HCl NHCl est égal au nombre
de moles de NaOH NNaOH. C'est à dire, si:
CHCl = NHCl/VHCl, et
CNaOH = NNaOH/ VNaOH;
Avec :NHCl = NNaOH, on obtient:
CHCl VHCl = CNaOH VNaOH
La mesure donne la valeur du volume titrant VNaOH, ce qui permet de
connaitre la concentration inconnue au départ de la solution titrée CHCl.
L'utilisation d'un indicateur coloré permet de repérer ce volume titrant. Des
mesures prises en utilisant un pHmètre et le tracé de la courbe pH versus volume titrant
permettent de déterminer le point d'équivalence
Par titrage donc, on obtient la valeur d'une concentration inconnue. On titre un acide
par une base (HCl par NaOH) ou une base par un acide (NH3 par HCl).
La relation ci-dessus entre les concentrations et et les volumes est valable pour
un monoacide comme HCl ou une monobase comme NaOH. Mais pour un diacide
comme l'acide sulfurique H2SO4 ou un triacide comme H3PO4
ou une dibase comme la chaux Ca(OH)2, il faut utiliser plutôt la normalité
de la solution.
La normalité d'une solution est égal au nombre équivalent par litre de cette solution. Pour
une réaction acide-base, un éqivalent représente la quantité d'acide ou de base qui peut donner
ou accepter exactement une mole de protons (H+). La normalité s'exprime en
éq/L. Par exemple, pour H2SO4, donneur de 2 protons H+, une
mole par litre de cet acide est capable de donner deux moles de protons; la quantité qui peut donner
une mole de protons est la moitié d'une mole.; donc 1 (<éq/L) = (1/2) (mol/L)
La relation concentration-volume devient ainsi Normalité-Volume:
NoHCl VHCl = NoNaOH VNaOH
Lors d'un titrage d'un acide, on passe de la solution acide, puis neutre
de point d'équivalence PH, puis une solution basique. Pour une
solution basique, le tracé de la courbe descend en passant par un point
d'équivalence PN. Les régions avant la montée pour l'acide et
la descente pour la base sont dites rgions de solution tampon
À la demi-neutralisation d'un acide d'équilibre:
AH ↔ A- + H+
, où l'on a
:[A-] = [HA] = [H+], la constante d'équilibre devient:
Ka = [A-][H+]/[AH] = [H+]
Et donc : pKa = pH
À la demi-neutralisation d'un acide: pKa = pH
À la demi-neutralisation d'une base d'équilibre:
BOH ↔ (OH)- + B+
, où l'on a
:[(OH)-] = [BOH] = [B+], la constante d'équilibre devient:
Kb = [(OH)-][B+]/[BOH] = [(OH)-]
Et donc : pKb = pOH
À la demi-neutralisation d'une base: pKb = pOH
6. Solutions Tampons
Une solution tampon est de pH quasiment constant qui s'obtient avec
un mélange d'acide faible avec sa base faible conjuguée et inversement .
Exemples:
1. Type: AH/A- (CH3COO-H /CH3COO- )
Le cas du mélange d'acide acétique CH3COOH (acide faible) avec et d'acétate de sodium
CH3COONa (base faible) où les deux espèses en présence contiennet un ion commun
CH3COO- a pour réaction:
CH3COOH + CH3COONa ↔ CH3COO- + H+ + CH3COO- + Na+
CH3COO- est la base conjuguée de l'acide CH3COOH
L'ion Na+ n'a aucune propriété basique ou acide, l'apparition du proton H+
due à la dissociation du à l'acide acétique réagi avec CH3COO-
due à la dissociation de l'acétate de sodium pour reformer l'acide acétique. La réaction d'équilibre est
en fait:
CH3COOH ↔ CH3COO- + H+
2. Type: BH+/B (NH4+/NH3)
Le cas du mélange de chlorure d'ammonium NH4Cl avec et l'ammoniac
NH3 où les deux espèses en présence contiennet un ion commun
NH4+ a pour réaction:
NH3 + NH4Cl ↔ NH4+ + Cl- + (OH)- + NH4+
L'ion Cl- n'a aucune propriété basique ou acide, l'apparition de l'ion hydroxyde (OH)+
due à la dissociation de l'ammoniac dans l'eau, réagi avec NH4+ ( acide faible)
due à la dissociation du chlorure d'ammonium pour reformer l'ammoniac (base faible). La réaction d'équilibre est
en fait:
NH3 ↔ NH4+ + (OH)-
Ou:
NH4+ ↔ NH3 + H+
NH3 est la base conjuguée de l'acide NH4+
Dans tous les cas, on :
Ka = [A-][H+]/[HA]
D'où:
- log Ka = - log [A-] - log [H+] + log [HA]
Ou:
pH = pKa + log([[A-]/[HA])
|