Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Les atomes
1. Les constituants de l'atome
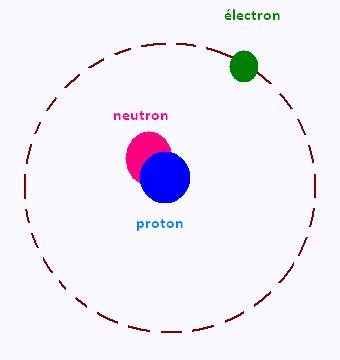 La matière est constitué d'atomes. un atome est constitué
d'un noyau autour duquel gravitent des électrons.
La matière est constitué d'atomes. un atome est constitué
d'un noyau autour duquel gravitent des électrons.
Le noyau est formé de nucléons. Chaque nucléon est constitué de
neutrons et de protons.
Le électrons portent de charges négatives, les prorons portent
des charges positives; mais les neutroons sont électriquement
neutres.
Le nombre d'électrons d'un atome est noté N. Son nombre de protons
est noté Z et est appelé numéro atomique .
Chaque atome possède une masse appelée masse atomique . On la
note A. Elle est égale à la somme du nombre de protons et du nombre de neutrons.
En chimie, un atome est appelé élement puisqu'il sert à construire
des molécules.
L'élement est représenté par un symbole caractérisé par une lettre X.
Ainsi, l'ecriture AZX représente l'élement X de
masse atomique A et de numéro atomique Z.
Un atome qui possède Z électrons possède aussi Z protons. Si l'atome perd des
électrons, il devient un cation. S'il en gagne, il devient
un anion . Les protons, de charges positives et les électrons, de
chrages négatives s'attirent mutuellement par des forces électrostatiques
dites de Coulomb.
Le nombre de protons, dans un atome est égal au nombre de ses neutrons. Le
nombre de protons ne varient pas. Si le nombre de neutrons est supérieur
au nombre de protons au sein d'un atome, on dit que l'atome est un isotope.
Pour un atome, ses isotopes diffèrent du nombre des neutrons.
| Constituants de l'atome |
| Constituant |
Symbole |
Charge élecrique (C) |
Masse (kg) |
| Proton |
p |
e= 1,602.10-19 |
mp=1,6726.10-27 |
| Neutron |
n |
0 |
mn=1,6749.10-27 |
| Électron |
e- |
-1,602.10- 19 |
me=9,1094.10-31 |
Les électrons, dans un atome, se logent dans des couches et des sous-couches.
La dernière couche est dite couche externe ou de valence ou périphérique.
Exemples
Exemple 1:
L'atome d'hydrogène est représenté par le symbole H. Il possède un proton,
donc Z = 1 et aucun neutron. L'abandance de cet atome est de 99,985 %. On le note
11H.
Son isotope 21H possède un proton et un
neutron, donc sa masse atomique est égale à 2. On note Z =1 et
A = 2. Son abandance est de 0.015 %.
Exemple 2:
L'atome de carbone est représenté par le symbole C. Il
possède 6 protons (donc Z = 6), et 6 neutrons. On le note
126C.
Son isotope 146C possède toujours 6 protons,
mais 8 neutrons, donc sa masse atomique est égale à 14. On note Z = 6 et A = 14.
La masse du proton est patiquement égale à celle du neutron. La masse d'un éléctron
est 1836 fois plus petite que celle d'un proton ou d'un neutron. Donc la masse de l'atome est
pratiquement égale à celle de ses nucléons, c'est à dire de son noyau.
2. La masse atomique
 Quelle est la masse d'un atome?
Quelle est la masse d'un atome?
On utilise l'atome de carbone.
On prend 12 grammes exactement de carbone 126C pur.
Dans 12 grammes de carbone 126C pur,
il ya une mole d'atome de carbone.
Une mole de "choses" est égale à 6.023 x 1023 "choses". Donc
6.023 x 1023 atomes de carbone pèsent 12 grammes; et donc 1 atome de
carbone pèse 12 grammes/6.023 x 1023 = 2.0 x 10- 23 g
ramme = 1.992 x 10- 26 kg.
NA = 6.023 x 1023 est le nombre d'Avogadro.
Combien pèse un proton?
On sait que la masse d'un atome est égale à la masse de ses
nucléons, c'est à dire la masse de ses protons et de ses neutrons.
La masse du neutron est pratiquement égale à celle du proton. Donc, dans
l'atome de carbone, les 12 nucléons pèsent 1.992 x 10- 26 kg, et
par conséquent, un nucléon pèse 1.660 x 10- 27 kg; c'est
l'unité de masse atomique.
12 grammes est la masse d'une mole de carbonne 126C (ou de
carbone tout court, c'est à dire le plus stable). On dit que la masse molaire
du carbone est égale à 12 grammes par mole. On note M = 12 g/mol.
À partir de l'unité de masse atomique, on peut connaitre la masse de
chaque atome,c'est à dire sa masse atomique. La masse d'un
atome est égale au nombre de ses nucléons fois l'unité de masse atomique.
Exemple:
L'atome de calcium possède 20 protons et 20 neutrons, donc 40 nucléons. Sa
masse est donc égale à: 40 x 1.660 x 10- 27 kg = 6.64 x 10- 26 kg.
Sa masse molaire, c'est à dire la masse d'une mole de Calcium vaut
donc: 6.64 x 10- 26 x 6.023 x 1023
kg = 39.993 x 10- 3 kg ≈ 40 grammes.
3. Classification des élements
Les atomes sont classés dans la table périodique des éléments dite table de
Mendeleïev. Dans ce tableau, les lignes sont appelées des périodes et
les colonnes sont appelés des groupes ou familles. Les périodes sont en
nombre de 7; les familles en nombre de 18 (18 clonnes). La première famille est
celle des alcalins, la deuxième celle de alcalino-terreux, l'avant
dernière (17 ème) celle des halogènes et la dernière (18 ème) celle des
gar rares, inertes ou nobles.
Les couches de valence des éléments d'une même famille comportent le même nombre
d'électrons. Les élements d'une même famille ont les mêmes propiétés chimiques.
On classe les élements en trois grandes parties:
Les métaux, les métalloides, et les non-métaux.
Les métalloides:
Ils sont tous des solides. On les trouve entre les métaux et les non-métaux. Ce sont: Le Bore,
le Silicium, le Gérmanium, l'Arsenic, l'Antimoine, le Tellure, le Polonium et l'Astate.
Les non-métaux:
- Gaz: L'hydrogène, l'Azote, l'oxygène, le fluore, le Chlore et tous les gaz rares.
- Liquides: Le brome
- Solides: Le Carbone, le Phosphore, le Soufre, le Sélénium et l'iode.
Ils sont placés dans les colonnes de droite.
Les métaux:
Ce sont les élements qui restent. Ils sont tous des solides sauf le Mercure qui est
liquide. Ils sont placés dans les colonnes de gauche.
Tableau périodique des éléments
| H |
|
He |
| Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
| Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
| K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
| Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
| Cs |
Ba |
* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
| Fr |
Ra |
** |
Rf |
Ha |
Sg |
Ns |
Hs |
Mt |
| * |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
| ** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
4. La formation des molécules
À part les gaz rares, les atomes on tendance à s'associer pour
former des groupements appelés molécules. Les atomes ne s'attachent
entre eux qu'avec des liaisons électrostatiques. Dans une liaison, il y a
des donneurs d'électrons appelés électropositifs et des accepteurs
d'électrons appelés électronégatifs. . Un atome est
électronégatif s'il est capable d'attirer des électrons. Les métaux
sont électropositifs et les non-métaux sont électronégatifs. Les alcalins
sont les moins électronégatifs. La famille du Fluor est par contre, la plus
électronégative.
En se basant sur les énergies de liaison de l'atome dans une
molécule, Pauling a défini une échelle de mesure de l'électronégativité
des atomes allant de 3.98 pour le Fluor jusqu'à 0.79 pour le Francium.
|