Chimie: Dureté d'une eau
1. Définitions
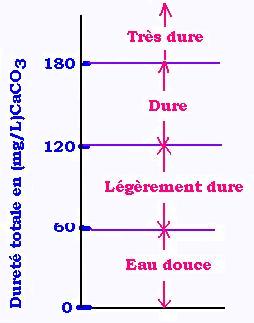 La dureté d'une eau est relative à sa concentration en cations
Ca2+ et en Mg2+.
La dureté d'une eau est relative à sa concentration en cations
Ca2+ et en Mg2+.
La dureté totale d'une eau est égale à la somme de sa dureté
calcique et de sa durée magnésienne.
Calcique se rapporte aux ions clacium Ca2+.
Magnésienne se rapporte aux ions magnésium Mg2+.
Une eau dure ( pas douce), donc très concentrée en cations minéraux Ca2+ et Mg2+ est dure
à laver puisque se sont ses cations qui s'emparent du savon comme le montre cette réaction chimique:
RCO2Na + Ca2+ → (RCO2)2Ca + 2 Na+. R est un radical, le composé
(RCO2)2Ca est insoluble.
Nous avons:
Dureté Totale = Dureté calcique + Dureté Magnésienne
Ces trois duretés s'expriment toutes en (mg/L)CaCO3
|
Remarque:
Si les duretés sont exprimées en (mg/L), on doit d'abord les
convertir en (mg/L)CaCO3 pour faire leur somme.
Exemples:
- 1. La dureté totale de l'eau du St-Laurent est de l'ordre du 120 (mg/L)CaCO3
- 2. Une eau a les paramètres suivants:
Ca2+ : 43.0 (mg/L)
Mg2+ : 6.9 (mg/L)
Pour calculer la dureté totale de cette eau, on converti d'abord les valeurs
des concentrations (teneures) de Ca2+ et de Mg2+en (mg/L)CaCO3. Il vient:
Ca2+ : 43.0 (mg/L)x 2 x 50 /40 = 107.5 (mg/L)CaCO3
Mg2+ : 6.9 (mg/L) = 6.9 (mg/L)x 2 x 50 /24 = 28.75 (mg/L)CaCO3
Donc:
Dureté totale est égale à : 107.5 + 28.75 = 136.2 (mg/L)CaCO3
De quoi sagit-il?
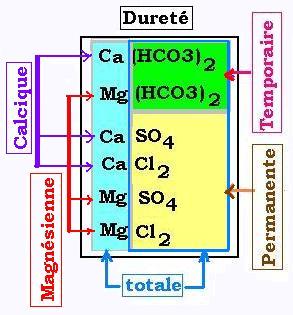 Une eau (H2O) où est dissous du gaz carbonique (CO2) réagi avec le
calcaire (CaCO3) pour produire le sel du bicarbonate de calcium Ca(HCO3)2.
Une eau (H2O) où est dissous du gaz carbonique (CO2) réagi avec le
calcaire (CaCO3) pour produire le sel du bicarbonate de calcium Ca(HCO3)2.
On ecrit:
CaCO3 + H2O + CO2 → Ca(HCO3)2 (aq)
C'est à dire, dans l'eau:
Ca(HCO3)2(aq) → Ca2+ + 2(HCO3)-
Pour les mêmes raisons, on obtient pour le bicarbonate de magnésium Mg(HCO3)2
MgCO3 + H2O + CO2 → Mg(HCO3)2 (aq)
C'est à dire, dans l'eau:
Mg(HCO3)2(aq) → Mg2+ + 2(HCO3)-
Les ions (cations) calcium Ca2+ et magnésium Mg2+ sont
responsables de la dureté totale de l'eau.
Lorsqu'on élève la température de cette eau jusqu'à ébullition,il se produit la
réaction inverse. Les sels Ca(HCO3)2 et Mg(HCO3)2 deviennent des carbonates de
Calcium CaCO3 et carbonates de magnésium MgCO3 respectivement. Ces carbonates sont
insolubles dans l'eau. (la réaction est réversible une seule fois).
Cependant, les anions HCO3- ne subsistent plus à une certaine
température, puisqu'ils se précipitent et deviennet insolubles. On dit que la dureté
qui leur est relative est temporaire ou carbonatée. Seuls pesistent les ions sulfate SO42-
et les ions chlorure Cl- de dureté permanente.
Nous avons:
Dureté totale = dureté calcique + dureté magnésienne
= dureté temporaire (ou carbonatée) + dureté permanente
|
Pour calculer la dureté calcique, on utilise la formule:
|
Dureté temporaire, ou carbonatée (en (mg/L)CaCO3) = [HCO3 - ]
|
2. Mesure de dureté totale et de la dureté calcique
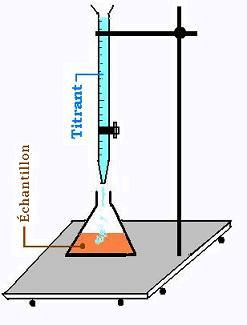
La mesure de dureté totale et calcite se fait au moyen du titrage.
Le titrant étant l'EDTA (Éthylène Diamine Tetra Acétate) de
concentration connue NEDTA(éq/L). On utlise un indicateur
coloré et on dose jusqu'au changement de couleur.
Dureté totale:
On ajoute à l'échatillon eau:
- une solution tampon et
- un indicateur coloré NET.
- Le changement est subtile (passage du violet au bleu)
Dureté calcique:
On ajoute à l'échatillon eau:
- une solution basique NaOH, et
- un indicateur coloré MUREXIDE.
Le virage est du rose au pourpe.
L'expression qui donne la valeur de la dureté provient de la formule du
point d'équivalece:
(concentration x Volume)burette = (concentration x Volume)erlenmeyer. Elle
s'ecrit:
| Dureté Calcique (en (mg/L)CaC03) =
5 x 104 x NEDTA x VEDTA /VÉch
|
Avec:
NEDTA : Normalité de l'EDTA (en eq/L),
VEDTA : Volume du titrant EDTA (en mL), et
VÉch: Le volume de l'echantillon (en mL)
Exemples:
Exemple 1:
1. On donne pour une eau, les concentrations suivantes:
Mg2+: 9.3 (mg/L), Ca2+ : 41.0 (mg/L), et HCO3- : 115.0 (mg/L)
Ca = 40 g/mol
Mg = 24 g/mol
HCO3 = 61 g/mol
CaCO3 = 100 g/mol
On a:
Dureté totale = dureté calcique (due aux ions Ca+2) + dureté magnésienne (due aux ions Mg2+)
Dureté temporaire = [HCO3- ]
On converti d'abord:
Ca2+ : 41.0 (mg/L) → 41.0 x 2 x 50 /40 = 102.5 (mg/L)CaC03
Mg2+ : 9.3 (mg/L) → 9.3 x 2 x 50 /24 = 38.75 (mg/L)CaC03
HCO3- : 115.0 (mg/L) → 115.0 x 1 x 50 / 61 = 94.3 (mg/L)CaC03
Donc,
Dureté magnésienne = 38.75 (mg/L)CaC03
Dureté temporaire = 94.3 (mg/L)CaC03
Dureté totale = Calcique + Magnésienne = 102.5 + 38.75 = 141.3 (mg/L)CaC03
D'où:
Dureté Permanente = Dureté totale - Dureté temporaire
141.3 - 94.3 = 47 (mg/L)CaC03
Exemple 2:
On veut déterminer la dureté d'une eau au moyen du titrage. On en prend
un échantillon VÉchde 50.0 mL et on la titre avec l'EDTA de concentration égale à 0.0200 (éq/L).
On donne sa concentration en ions bicarbonates [HC03- ] = 150 (mg/L)CaC03; qui
est en fait sa dureté temporaire ou carbonatée.
Le premier titrage relatif à la dureté calcique (eau + NaOH + MUREXIDE), donne:
VEDTA = 4.55 mL, au virage Rose → Pourpe. On a donc:
Dureté Calcique (en (mg/L)CaC03) = 5 x 104 x NEDTA x VEDTA /VÉch
= 5 x 104 x 0.0200 x 4.55 /50.0 = 91.0 (mg/L)CaC03
Le deuxième titrage relatif à la dureté totale (eau + Tampon + NET), donne:
VEDTA = 10.15 mL, au virage Violet → Bleu. On a donc:
Dureté Totale (en (mg/L)CaC03) = 5 x 104 x NEDTA x VEDTA /VÉch
= 5 x 104 x 0.0200 x 10.15 /50.0 = 203.0 (mg/L)CaC03
D'où:
Dureté magnésienne = Dureté totale - Dureté Calcique = 203.0 - 91.0 = 112 (mg/L)CaC03.
Et
Dureté Permanente = Dureté totale - Dureté Temporaire = 203.0 - 150 = 53 (mg/L)CaC03.
|