Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
|
Chimie: Piles
1. Pile Daniell
1. Définitions
La pile Daniell comporte une anode en Zinc plongée dans une solution de son sel ZnSO4 et une cathode en cuivre
plongée dans une solution de son sel CuSO4. Elle comporte un pont électrochimique appelé pont salin qui sépare
les deux demi-piles. Géneralement ce pont est du type chlorure de potassium (K+ + Cl-), de
Nitrate de potassium (K+ + NO3-), ou sulfate d'ammonium (NH4+ + SO4-).
2. Pile débitrice
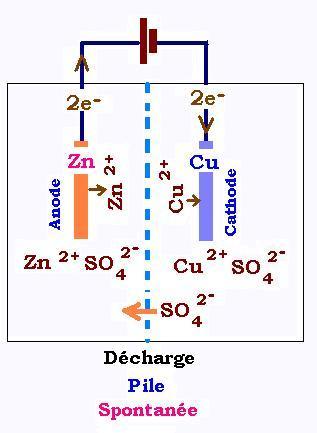
Sur l'anode:, il se produit l'oxydation du Zn:
Zn → Zn 2+ + 2e- (1.1)
Sur la cathode:, il se produit la réduction du cuivre:
Cu2+ + 2e- → Cu (1.2)
La réaction globale s'ecrit:
Zn + Cu2+ & rarr; Zn2+ + Cu (1.3)
C'est une réaction spontanée qui ne nécessite aucune énergie pour se faire. La pile se
décharge du point de vue électrolyte (sloution où plongent les électrodes) fournissant ainsi une tension(ddp) ou une fém
(force électromotrice) de 1.1 Volt Dans les condition standars(T = 25 oC, P = 101.3 kPa).
3. Pile rechargée
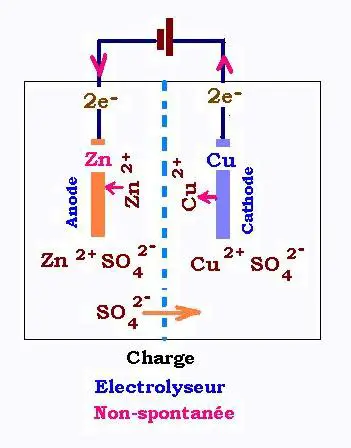
Lorsqu'en veut charger la pile (sous une tension d'au mons 1.1 Volt), les rôles sont inversés. Le courant des électrons
doit arriver à l'anode de zinc qui sera réduit:
Zn2+ + 2e - → Zn (2.1)
À la cathode, le cuivre est oxydé:
Cu → Cu2+ + 2e- (2.2)
La réaction globale s'ecrit:
Zn2+ + cu → Zn + Cu2+ (2.3)
4. Remarques
1.Au cours de la décharge, la plaque en cuivre s'agrandit et celle du zinc se retrécit.
Les ions sulfates passent à l'anode pour neutraliser ls ions Zn2+
2.Au cours de la charge, la plaque en zinc s'agrandit et celle du cuivre se retrécit.
Les ions sulfates passent à la cathode pour neutraliser ls ions Cu2+
3. Pendant la charge, l'équation (1.1) est une oxydation: Zn/Zn2+; (1.2) est une réduction : Cu2+/Cu .
L'equation globale (1.3) est dite une réaction d'oxydation ou Rédox. On représente la pile Daniell par le schéma:
Zn/Zn2+//Cu2+/Cu
2. Accumulaeurs au Plomb
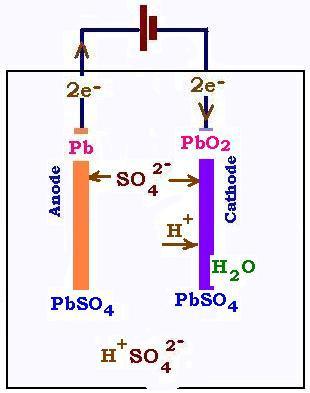
un accumulateur est une suite de piles en série, généralement de 6. La pile au plomp débite dans les conditions satandars
une tension de 2 Volts, ce qui donne une battererie de 12 Volts. Cette pile fonctionne avec deux électrodes en Plomb Pb et dioxyde de
Plomb PbO2 plongées dans une solution d'acide sulfurique H2SO4 comme électroyte.
À l'anode, le Pb s'oxyde:
Pb + SO42- → PbSO4 + 2e-
(les Pb2+ réagissent avec les ions sulfates SO4sup>2-)
À la cathode, le dioxyde de plomb est réduit:
PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
|