Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Potentiels d'électrodes
1. Introduction
Dans le cas d'une pile, la différence de potentiel entre la cathode et l'anode
ΔEo = Eco - Eao est appélé la fem: force électromotrice
de la pile. Elle vaut fem = ΔEo = ECuo - EZinco = 1.1 Volts pour une
pile Daniell. L'indice o signifie "dans les conditions satandard". On utilise une électrode de réference: celle de l'hydrogène
dans les conditions standard avec un potentiel nul. La différence de potentiel standard s'ecrit:
ΔEo = Eco - Eao pour une pile.
ΔEo = Eao - Eco pour une électrolyse.
(1)
Dans d'autres conditions autre que les conditions
standard (25 oC et 1bar), la difference de potentiel est donnée par la loi de Nernst:
ΔE = ΔEo - 0.06 x pH
(2)
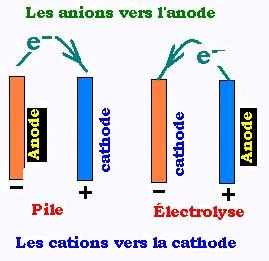
les potentiels standard d'électrode Eo sont tabulés. Ils sont déterminés par la mesure de la fem entre chacune des
demi-piles et électrode de référence . Ils sont positifs pour la cathode (face à l'électrode de réference) où s'effectue la
réduction et négatifs dans l'anode (face à l'électrode de réference) où s'effectue l'oxydation. Les électrons remontent
le potentiel; ainsi l'électron passe de l'anode (-) à la cathode (+) dans une pile. Dans le cas de l'électrolyse, la cathode
devient anode (+) et l'anode devient cathode (-). Pour une électrolyse, la ddp d'electrode est ΔEo = Eao - Eco.
Un système d'électrolyse est composé d'une cellule d'électrolyse (électrodes, electrolyte) et d'un générateur. Dans un
système rapide, le passage d'un courant est directement observé dès que la tension entre les électrodes est égale à
la différence de spotentiels standard ΔEo. Mais pour les systèms lents, une surtension est requise
entre les élecrodes pour libérer le passage du courant. Les voltages additionnels au niveau de la cathode ηc et
au niveau de l'anode ηa sont dits surtention cathodique et surtension anodique. Ils sont du aux
résistances électriques des életrodes. La ddp prend donc la forme suivante pour une electrolyse:
Umin = (Eao + ηc) - (Eco + ηc)
(3)
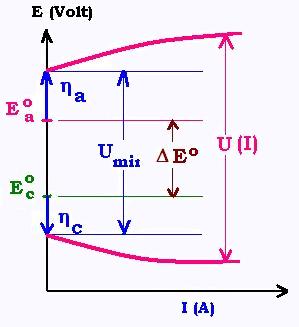
Si l'on tient compte de la résistance R de l'électrolyte, la tension d'opération s'ecrit:
U = (Eao + ηc) - (Eco + ηc) + RI
(4)
cette résistance depend de la conductivité de l'électrolyte,de la distance entre les électrodes et de la
présence d'un séparateur entre ces électrodes dans une cellule.
La formule de Nernst devrait toujours être appliquée pour une valeur de ddp d'électrodes. Son deuxième terme
0.06 x pH est est important avec des électrodes à oxygène et hydrogène. Dans ce cas, ce term 0.06 pH s'annule dans
les expressions des ddp, mais il est significatif pour les valeurs des potentiels et surtout lorsqu'il
s'agit à définir les réactions préférentielles:
Eanode(O2) = Eao - 0.06 pH + ηa
Ecathode(H2) = - 0.06 pH + ηc
Les réactions préférentielles aux électrodes se font avec le potentiel le plus bas en anode
et le plus haut en cathode.
2. Réactions possibles aux électrodes
la composition de l'électrolyte, de la nature des électrodes et de la tension appliquée aux bornes
des électrodes donnent lieu à divers réactions, telles que:
Sur l'anode:
Oxydation de l'eau avec dégaement d'oxygène:
H2O → 2e- + 2H+ + (1/2)O2
Oxydation d'un anion avec dégagement d'un gaz:
2Cl- → 2e- +Cl2
Oxydation avec dissolution de l'électrode:
Cu → 2e- + Cu2+
Oxydation d'ions:
anion: 2SO42- → 2e- +S2O82-
Cation: Fe2+ → e- + Fe3+
Sur la cathode:
Réduction de l'eau avec dégagement d'hydrogène:
2H+ + 2e- → H2
Réduction d'un cation avec dépot métallique:
Cu2+ + 2e- → Cu
Réduction de cations:
Fe3+ + e- → Fe2+
3. Applications:

Application 1:
Électroyse d'une solution aqueuse de Al2(SO4)3 à pH = 6 avec électrode inerte
en platine (Pt), avec η(O2/Pt) = + 0.5 V et η(H2/Pt) = - 0.1 V.
Les éelements present dans l'électrolyte sont: Al3+, SO42- et H2O.
Les électrons descendent potentiel des électrodes (du + vers -) lors d'une électrolyse:
Donc Cathode : réduction et Anode : oxydation.
Cathode:
Les cations H+ et Al+ vont vers la cathode pour être réduit:
2H+ + 2e- → H2 (1) Eo = 0.00,
E = Eo - 0.06 pH = - 0.06 pH = - 0.06 x 6 = - 0.36 V. Compte tenu de la surtention, E = - 0.36 + ηc =
- 0.36 - 0.1 = - 0.46 V
Al3+ + 3e+ → Al (2) Eo = - 1.66 V = E; ηc est negligeable
pour un métal.
Anode:
Les anions SO42- et Les molécules H2O vont vers l'anode pour s'oxyder.
SO42- → S2O82- + 2e- (3) Eo = 2.01 V = E;
ηa est negligeable.
2H2O → O2 + 4H+ + 4e- (4) Eo = 1.23 V,
E = 1.23 - 0.06pH = 1.23 - 0.06 x 6 = 0.87 V. Compte tenu de la surtention, E = 0.87 + ηc =
0.87 + 0.5 = 1.37V
Les réactions préferentielles se font avec un bas potentiel en anode (E = 1.37 V ) et un haut
potentiel en cathode (E = - 0.46 V). Ce sont donc les équations (1) et (4):
2H+ + 2e- → H2
2H2O → O2 + 4H+ + 4e-
Donnant la réaction globale:
2H2O → 2H2 + O2
Umin = 1.37 - 0.46 = 1.83 V.
Application 2:
Electrolyse de l'eau:
Milieu acide:
Cathode: Réduction des cations H+: 2H+ + 2e- → H2
Anode: Oxydation de l'eau: 2H2O → O2 + 4H+ + 4e-
Milieu basique:
Cathode: Réduction de l'eau: 2H2O + 2 e- → H2 + 2OH-
Anode: Oxydation des anions OH-: 4OH- → O2 + 2H2O + 4e-
Application 3:
Electrolyse d'une soltion aqueuse de ZnSO4 (1M) à pH = 2 (donc acide) avec
anode inerte en platine et cathode en aluminium où
ηc(H2/Al) = - 0.8 V,
ηc(H2/Zn) = - 0.7 V, et
ηc(O2/Pt) = +0.5 V
:
Cathode:
Zn2+ + 2 e- → Zn Eo = - 0.76 V (1)
2H+ + 2e- → H2
E = Eo - 0.06pH + ηc(H2/Zn) = 0 - 0.06 x 2 - 0.7 = - 0.82 V (2)
2H+ + 2e- → H2
E = Eo - 0.06pH + ηc(H2/Al) = 0 - 0.06 x 2 - 0.8 = - 0.92 V (2')
Anode:
2So42- → S2O82- + 2e- Eo = + 2.00 V (3)
2H2O → O2 + 4e- + 4H+
E = Eo - 0.06pH + ηa (O2/Pt) = 1.23 - 0.06 x 2 + 0.5 = 1.61 V (4)
Rx preferentielles: (4) et (1):
2H2O → O2 + 4e- + 4H+
Zn2+ + 2 e- → Zn
Rx globale:
22O + 2Zn2+ → 2 + 4H+ + 2Zn
Le dépôt du Zn sur l'Al se poursuit jusqu'au moment où l'Al soit totalement
couvert de Zn. Ainsi l'Al ne produit plus d'H2.
Application 4:
Electrolyse d'une soltion aqueuse de NaCl sur cathode de fer et anode en titatne platiné.
On donne:
Côté Anode: pH = 4 (donc acide) et côté cathode pH = 14 (donc basique)
ηc(H2/Fe) = - 0.1 V,
ηa(Cl2/Pt) = - 0.0 V, et
ηa(O2/Pt) = + 0.5 V
:
Cathode:
Na+ + e- → Na Eo = - 2.07 V (1)
2H2O + 2e- → H2 + 2OH-
E = - 0.06pH - 0.1 = - 0.94 V (2)
Anode:
2Cl- → Cl2 + 2e- (3) Eo = + 1.36 V
2H2O → O2 + 4e- + 4H+
E = Eo - 0.06pH + ηa (O2/Pt) = 1.23 - 0.06 x 4 + 0.5 = 1.49 V (4)
Rx preferentielles: (3) et (2):
2Cl- → Cl2 + 2e-
2H2O + 2e- → H2 + 2OH-
Rx globale:
2Cl- + 2H2O → Cl2 + H2 + 2OH-
ou:
2NaCl + 2H2O → Cl2 + H2 + 2NaOH
|