Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
|
Chimie: Absorption
I. Cristallisation d'un mélange binaire:
Une substance se cristallise si elle passe d'une phase liquide
à une phase solide. L'eau se cristallise à des températures négatives en degrés Celcius.
L'eau saline se composant d'eau et d'ions Na+(aq) et Cl-(aq), en s'évaporant
laisse le cholrure de sodium NaCl solide
sous forme de cristaux solides.
Dans le cas d'un mélange binaire A + B de températures de solidifications respectives Ta
et Tb, la cristallisation, par diminution de la température, commence par celle du plus
solidifiable, soit B, pour obtenir un mélange L" liquide A + liquide B + solide B". Pour le
mélange "eau + éthanol" de températures de fusion ou de solidification respectives
0oC et - 114 oC,
l'eau s e solidifie la première. Entre 0oC et - 114 oC, nous avons un mélange
eau solide + éthanol liquide. À partir de - 114 oC, nous avons un mélange solide-solide
eau - éthanol. En général, une courbe d'équilibre de cristallasion se présente sous cette forme:
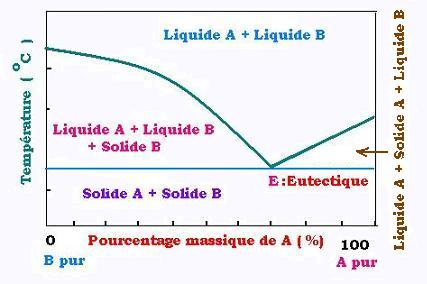
Le point E est appelé l'eutectique. À cette proportion précise, le diagramme de solidification du
mélange se divise en deux parties:
À gauche: A liquide + B solide et B liquide;
À droite, A liquide et A solide + B liquide.
La courbe donne le pourcentage y% de liquide du constituant A (qui ne se solidifie pas à gauche)
à une température donnée. Si z% est la concentartion de A dans le mélange liquide, y% est plus grand
que z% à gauche de l'eutectique; l'inverse se produit à droite.
Le mélange solide-liquide est très utilisé pour une purification par recristallisation. Pour un
constituant A taché d'impuretés et missible avec un constituant B, on mélange les deux
liquides, on filtre les impuretés et on recristallise pour retrouver le constituant A pur.
II. Technique de cristallisation:
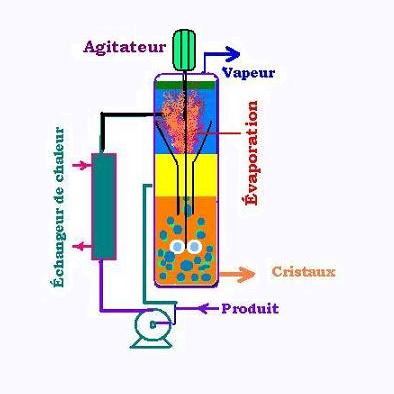
Une cristallisation se fait au moyen de deux procédés:
Un simple refroidissement,
Une évaporation utilisant un cristallisoir.
La cristallisation d'une solution "soluté + solvant" ou un mélange "A + B" commence par une
nucléation de formation de petits cristaux. La concentration du soluté soluble dans
le solvant doit être en sursaturation pour que la cristallisation commence et croit. En
saturation ou en dessous de la saturation la cristallasion ne peut avoir lieu. Avec la température
de la solution, ces deux paramètres contrôlent le phénomène de cristallisation. signalons enfin que
la croissance des cristaux dépend aussi des impuretés présentes dans la solution. Elles sont en inclusion
lorsqu'elles sont présentes à l'interieur du cristal et en occlusion lorsqu'elles se présentent
en surface du cristal.
Dans un cristallisoir, le produit à cristalliser se compose d'une partie pompée de l'extérieur et
d'une partie venant de la solution du cristallisoir. À travers un changeur de chaleur, le produit
est chauffé. À l'entrée, l'évaporation du solvant fait chuter la température en haut du
cristallisoir et les cristaux se forment et se précipitent. La solution liquide concentrée reste au
dessus de la zone basse de formation des cristaux. Celle-ci, avec le produit frais arrivant de l'exterieur
constituent l'alimentation en solution sursaturée à l'entrée en haut du cristallisoir. Les cristaux sont
recueilli en bas du cristallisoir. l'agitateur, en plus de garder en suspension les cristaux, il les
fait circuler et monter jusqu'en haut du cristallisoir qui est la zone de sursaturation,
où la concentration du solvant et la plus faible et où la température est la plus basse.
III. Calculs relatifs au bilan massique
d'une cristallisation:
Bilan massique de cristallisation du
mélange A et B avant l'eutectique |
|