Chimie: Dissolution des composés chimiques
1. Définitions:
Si on peut former une molécule, il existe aussi des moyens pour
le procédé inverse qui est la dissociation ou la décomposition
d'une molécule. Les deux processus de formation et de décomposition se font
au cours d'une réaction chimique; c'est à dire lors d'un "mélange" de
substances identiques ou différentes. Cependant, pour une molécule de type
ionique (comme NaCl) ou de type covalente polaire (comme HCl ou H2O),
leur mélange avec certaines substances particulières ne donnent aucun nouveau
produit. Ces substances particulières appelées solvants permettent
juste de séparer leurs ions et de les isoler. On obtient ainsi des composés
ioniques dans le solvant. Cette opération est dite dissolution. Le solvant
le plus utilisé est l'eau.
On dissolve soit des acides, soit des bases ou des sels.
Un sel, comme le NaCl, est un composé ionique. Il est formé de cations
et d'anions. La charge nette d'un sel est nulle, c'est à dire
neutre électriquement. Le nombre de charge des cations dans un
sel est égal à celui des anions. Les ions en présence peuvent être formés soit
par un seul atome, comme le Na+, et sont dits alors monoatomiques,
soit par plusieurs atomes (comme le CO32-) et sont alors appelés
polyatomiques. Les ions peuvent être aussi bien métalliques (comme
Na+ ou Fe2+) que non-métallique (comme (OH)- ou
CH3COO- qui est ion ion organique).
Lorsqu'un sel est soluté et que l'eau est le solvant, la solution obtenue
s'appelle électrolyte.
2. Exemples:
2.1. Dissociation du chlorure de sodium dans l'eau
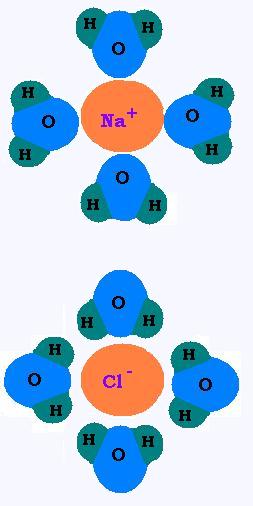
Si l'on verse du NaCl dans l'eau, les molécules d'eau se précipiteront
autour des ions Na+ et Cl- pour les solvater ou
hydrater. les cations hydrogènes de l'eau H+ rencontrent
les anions chlore Cl- et les anions oxygènes de l'eau O-
rencontrent les cations sodium Na+.
Le chlorure de sodium NaCl est le soluté, l'eau
qui l'acceuille est le solvant. Le mélange "eau + sel" est la solution.
Comme le solvant est de l'eau, on parle de solution aqueuse. Les ions Na+
et Cl- sont solvatés ou hydratés. On dit aussi qu'ils
sont aqueux et on les note: Na+(aq) et Cl-(aq)
2.2. Dissociation de l'eau dans l'eau
La molécule d'eau est polaire. Elle possède deux liaisons covalentes
polaires. Comme dans la dissolution de NaCl, Une molécole d'eau dans
l'eau vient, côté oxygène, isoler les H+. De l'autre
côté, les deux atomes d'hydrogène isolent ce qui reste de la molécule
d'eau, c'est à dire les ions (OH)-. Bien entendu, l'atome
d'oxygène perdant un hydrogène voit sa couche externe vidée de
l'électron qui assurait l'octet, ne se présente pas par lui même
comme un anion, c'est le groupement (OH) qui le fait. c'est toute
la liaison (OH) qui est un anion.
De ce fait, même si les atomes d'hydrogène sont liés aux atomes
d'oxygène, il existe toujours des ions cations H+
et de ions anions (OH)- dans l'eau. Ces ions sont
en nombre de 10-7 mol/litre. On ecrit:
H2O ↔ H+ + (OH)-
3. Les composés ioniques aqueux
3.1. Dissociation des sels dans l'eau
3.1.1. Dissolution du sulfate
de Barium BaSO4 dans l'eau
Le barium fait partie du groupe (ou famille) 2/IIA, des métaux
alcalino-terreux, donc de valence + 2 → l'ion cation Ba2+.
En se dissociant dans l'eau, le groupe d'atomes non-métallique SO4,
avec qui il est lié, devienda l'anion associé (SO4)2-.
Les ions obtenus sont hydratés, nous avons donc:
Ba2+(aq) et (SO4)2-(aq)
Nous ecrivons:
BaSO4 → Ba2+(aq) + (SO4)2-(aq)
3.1.2. Dissolution du monoxyde
de sodium Na2O(cristal) dans l'eau
Na2O est un groupement Métal-Non-Métal, c'est un oxyde
métallique.
Na fait parie de la famille ( ou groupe) des alcalins, donc un électron
de valence → Na+. L'oxygène O est non-métallique; il aura
besoin de deux électrons pour compléter sa couche périphérique à 8. Un seul
Na ne suffit pas. Il en faut deux; donc 2 Na; d'où le groupement Na2O.
La dissociation se fait de la façon suivante:
Na2O → 2 Na + O → 2 Na+(aq) + O2 - (aq)
Mais l'ion O2 - est très instable dans l'eau. Il prendra
ses deux cations H+ des deux molécules du solvant eau :
O2 - (aq) + 2 H2O ou O2 - (aq) + 2 H+ + 2(OH)- → H2O + 2(OH)-
Finalement, on a:
Na2O → 2 Na+(aq) + H2O + 2(OH)-
c'est à dire, dans l'eau:
Na2O → 2 Na+(aq) + 2(OH)-(aq)
3.1.3. Dissolution du mélange
Pb(NO3)2 et du KI dans l'eau
La réaction chimique équilibrée est la suivante:
Pb(NO3)2(aq) + 2 KI(aq) →
PbI2(s) + 2 K(NO3)(aq)
Le sel Pb(NO3)2 est composé Méta-Non-Métal. C'est le résultat d'une
réaction entre un oxacide H(NO3)2 et un hydroxyde Pb(OH). C'est un
Nitrate de Plomb. Son électronégativité est de +4, +2.
Nous considérons le cation Pb2+. Il lui correspondra l'anion (NO3)2-.
Pour le composé KI, le Potassium K appartient aux alcalins, donc K+,
l'iode correspondant doit être I-.
En solution aqueuse, les composés ioniques échangent les partenaires;
Comme réactifs, nous aurons:
Pb2+(aq) + 2 NO3)-(aq) + 2 K+(aq) +
2 I-(aq)
Les ions Plomb et Iode forment un précipité insoluble PbI2, donc:
Pb2+(aq) + 2 I-(aq) → PbI2
Nous avons:
Pb2+(aq) + 2 NO3)-(aq) + 2 K+(aq) +
2 I-(aq) →
PbI2(s) + 2 NO3)-(aq) + 2 K+(aq)
Il reste:
Pb2+(aq) + 2 I-(aq) → PbI2(s)
Résumé:
L'équation moléculaire:
Pb(NO3)2(aq) + 2 KI(aq) → PbI2(s) + 2 K(NO3)(aq)
L'équation ionique complète:
Pb2+(aq) + 2 (NO3)-(aq) + 2 K+(aq) + 2 I-(aq) →
PbI2(s) + 2 (NO3)-(aq) + 2 K+(aq)
L'équation ionique nette:
Pb2+(aq) + 2 I-(aq) → PbI2(s)
Les 2 (NO3)-(aq) et les deux 2 K+(aq)
ne participant pas à la réaction,
sont appelés ions inertes ou spéctateurs
3.2. Dissociation des acides dans l'eau
La dissociation d'un acide donne un ion H+
Exemple:
HCl + H2O →
Cl-(aq) + (H3O)+(aq) →
Cl-(aq) + H+(aq) + H2O
Dans l'eau, HCl →
H+(aq) + Cl-(aq)
L'acide chlorhydrique HCl est un acide fort, il se dissocie
complètement.
Mais dans le cas d'un acide faible, comme HNO2, la réaction
de dissociation est partielle. Nous aurons:
Dans l'eau, HNO2 ↔
H+(aq) + (NO2)-(aq)
De même, HF est un acide faible, nous avons:
Dans l'eau, HF ↔
H+(aq) + F-(aq)
3.3. Dissociation des bases dans l'eau
La dissociation d'une base donne un ion OH-
Exemple:
NaOH + H2O →
Na+(aq) + (OH)-(aq)
Dans l'eau, NaOH →
Na+(aq) + (OH)-(aq)
La soude NaOH est un base forte, elle se dissocie complètement.
Mais dans le cas d'un acide faible, comme l'ammoniac NH3,
la réaction de dissociation est partielle. Nous aurons:
Dans l'eau, NH3 ↔
(NH4)+(aq) + (OH)-(aq)
4. Exercices
Ecrire les equations de dissociation des substances suivantes:
1. La chaux:
Ca(OH)2 est une base qui
se décompose selon l'équation:
Ca(OH)2 → Ca2+(aq) + 2(OH)-(aq)
2. Le Chlorure de Magnésium:
Mg(Cl)2 est sel qui
se décompose selon l'équation:
Mg(Cl)2 → Mg2+(aq) + 2(Cl)-(aq)
3. L'Acide Carbonique :
H2CO3 est un acide qui
se décompose selon l'équation:
H2CO3 → H+(aq) + (HCO3)-(aq)
4. L'Acide Phosphorique :
H3PO4 est un acide qui
se décompose selon l'équation:
H3PO4 → H+(aq) + (H2CO3)-(aq)
5. Le Sulfate de Sodium:
Na2SO4 est un sel qui
se décompose selon l'équation:
Na2(SO)4 → 2 Na+(aq) + (SO4)2-(aq)
6. Le Chromate de Potassium :
K2CrO4 est un sel qui
se décompose selon l'équation:
K2CrO4 → 2 K+(aq) + (CrO4)2-(aq)
7. L'Acide Acétique (vinaigre):
CH3COOH est un acide qui
se décompose selon l'équation:
CH3COOH → H+(aq) + (CH3COO)-(aq)
8. Le Chlorure de Potassium: KCl est un sel qui
se décompose selon l'équation:
KCl → K+(aq) + Cl-(aq)
9. Le Nitrate de Sodium:
NaNO3 est un sel qui
se décompose selon l'équation:
NaNO3 → Na+(aq) + (NO3)-(aq)
10. L'Hydroxyde d'Amonium:
NH4OH est une base qui
se décompose selon l'équation:
NH4OH → (NH4)+(aq) + (OH)-(aq)
|