Chimie des solutions
Cinétique chimique
Distillation
Procédés de séparation
Polymérisation
Électrolyse
Traitement eau
© The scientific sentence. 2007
| |
| Chimie: Électrolyses<
1. Electrolyse de l'eau
 L'eau pure est très faiblement conductrice. Pour faire son électrolyse,
la présence d'ions est nécessaire pour avoir une solution aqueuse ionique.
On utilise donc une solution acide, basique ou neutre.
L'eau pure est très faiblement conductrice. Pour faire son électrolyse,
la présence d'ions est nécessaire pour avoir une solution aqueuse ionique.
On utilise donc une solution acide, basique ou neutre.
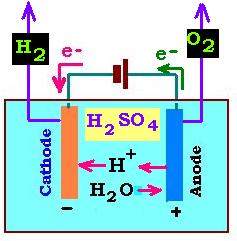
1.1. Électrolyse de l'eau en solution acide:
Les électrodes sont généralement en platine et la pile a une tension de 4.5 Volts.
Pour la solution d'acide, on utilise l'acide sulfurique: H2SO4. Ainsi, les espèses chimiques présentes en solution
sont l'eau H2O et les ions H+ et SO42- prevenant de la dissociation de
H2SO4:
H2SO4 → 2H+ + SO42- (1.1.1)
Sur la cathode, les électrons y parviennent à partir de la pile fournissant l'énergie électrique
nécessaire. Sur la cathode les ions H+ de l'acide présent dans l'eau réagissent avec ces
électrons pour former des molécules de dihydrogène H2. C'est la réaction de réduction.
L'ion H+ est réduit en
H2 en captant des électrons.
2H+ + 2e- → H2 (1.1.2)
Sur l'anode, d'où partent des électrons, il se produit une oxydation: l'eau est oxydé en dioxygène en
fournissant des électrons:
H2O → (1/2)O2 + 2H+ + 2e- (1.1.3)
(1.1.2) + (1.1.3) donnent l'équation bilan:
2H2O → 2H2 + O2 (1.1.4)
Remarques:
1. Les ions H+ de l'acide consommé par la cathode sont produit
à partir de l'eau dans l'anode.
Les ions sulfates SO42- ne participent pas à la réaction. Ce sont des
ions spéctateurs.
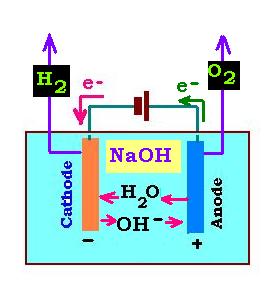 1.2. Électrolyse de l'eau en solution alcaline:
1.2. Électrolyse de l'eau en solution alcaline:
Pour la solution basique, on utilise la solution d'hydroxyde de sodium NaOH. Ainsi, les espèses chimiques présentes en solution
sont l'eau H2O et les ions Na+ et OH- prevenant de la dissociation de
NaOH:
NaOH → Na+ + OH- (1.2.1)
Sur l'anode, d'où partent des électrons, il se produit une oxydation: l'ion hydroxyde OH- est oxydé en dioxygène en
fournissant des électrons:
2OH- → (1/2)O2 + H2O + 2e- (1.2.2)
Sur la cathode, l'eau H2O receuilli dans l'anode passe à la cathode où il est réduit
en captant les életrons en provenance de la pile débitrice pour former des molécules de dihydrogène
H2 et des ions hydronium OH-. C'est la réaction de réduction:
2H2O + 2e- → H2 + 2OH- (1.2.3)
(1.2.2) + (1.2.3) donnent l'équation bilan:
2H2O → 2H2 + O2 (1.2.4)
Remarques:
1. Les ions OH- de la base consommés dans l'anode sont produit
à partir de l'eau dans la cathode.
2. Les ions sodium Na+ ne participent pas à la réaction. Ce sont des
ions spéctateurs.
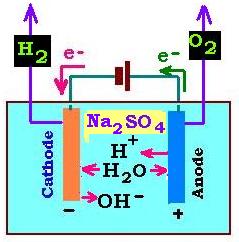 1.3. Électrolyse de l'eau en solution neutre:
1.3. Électrolyse de l'eau en solution neutre:
Pour la solution neutre, on utilise la solution de sulfate de sodium Na2SO4. Ainsi, les espèses chimiques présentes en solution
sont l'eau H2O et les ions Na2+ et SO42- prevenant de la dissociation de
N2SO4:
Na2SO4→ 2Na+ + SO42- (1.3.1)
Sur l'anode, d'où partent des électrons, il se produit une oxydation: l'eau H2O est oxydé en dioxygène en
fournissant des électrons:
H2O → (1/2)O2 + 2H+ + 2e- (1.3.2)
Sur la cathode, l'eau H2O passe à la cathode où il est réduit
en captant les életrons en provenance de la pile débitrice pour former des molécules de dihydrogène
H2 et des ions hydronium OH-. C'est la réaction de réduction:
2H2O + 2e- → H2 + 2OH- (1.3.3)
(1.3.2) + (1.3.3) donnent, avec OH- + H+ = H2O, l'équation bilan:
2H2O → 2H2 + O2 (1.2.4)
Remarques:
1. L'eau est consommée dans l'anode et produit des H+. Dans la cathode, elle
produit des OH-. Donc pour une molécule d'eau consommée, il se produit une molécule
d'eau par électrolyse.
2. Les ions sodium Na+ et SO42- ne participent pas à la réaction. Ce sont des
ions spéctateurs.
3. Dans une électrolyse à solution neutre, il se produit la même oxydation en anode en solution acide; et
la même reduction en cathode en solution basique.
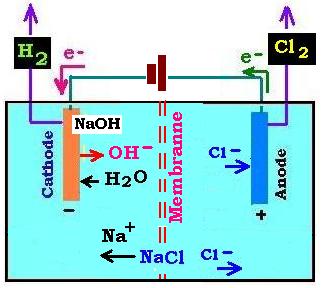 1.4. Électrolyse de l'eau salée:
1.4. Électrolyse de l'eau salée:
On utilise une membranne séparant les deux parties de l'electrolyseur. Les espèses chimiques présentes en solution
sont l'eau H2O et les ions Na+ et Cl- prevenant de la dissociation du
chlorure de sodium NaCl:
NaCl → Na+ + Cl- (1.4.1)
Sur l'anode, d'où partent des électrons, il se produit une oxydation: le chlore Cl- est oxydé en dichlore en
fournissant des électrons:
Cl- → Cl2 + 2e- (1.4.2)
Sur la cathode, l'eau H2O passe à la cathode où il est réduit
en captant les életrons en provenance de la pile débitrice pour former des molécules de dihydrogène
H2 et des ions hydronium OH-. C'est la réaction de réduction:
2H2O + 2e- → H2 + 2OH- (1.4.3)
(Na+ + 1.4.2) + (Na+ + 1.4.3) donnent, avec Na+ + Cl- = NaCl, l'équation bilan:
2NaCl + 2H2O → 2NaOH + Cl2 + H2 (1.2.4)
Remarque:
1. Les ions sodium Na+ traversent la membranne pour réagir avec les ions hydronium OH- et former
la soude NaoH qui s'accunmule sur la cathode.
|