Chimie au cegep
Chimie & petrochimie
Chimie & laboratoires
© The scientific sentence. 2010
| |
|
Chimie: Les constituants de l'atome
Les constituants de l'atome
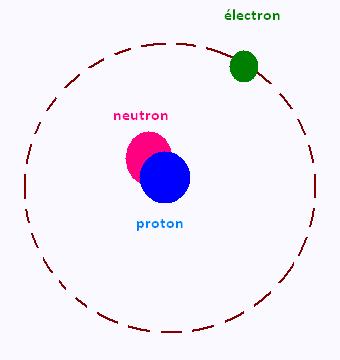 La mati�re est constitu� d'atomes. un atome est constitu�
d'un noyau autour duquel gravitent des �lectrons.
La mati�re est constitu� d'atomes. un atome est constitu�
d'un noyau autour duquel gravitent des �lectrons.
Le noyau est form� de nucl�ons. Chaque nucl�on est constitu� de neutrons et de protons.
Le �lectrons portent de charges n�gatives, les prorons portent
des charges positives; mais les neutroons sont �lectriquement
neutres.
Le nombre d'�lectrons d'un atome est not� N. Son nombre de protons
est not� Z et est appel� num�ro atomique .
Chaque atome poss�de une masse appel�e masse atomique . On la
note A. Elle est �gale � la somme du nombre de protons et du nombre de neutrons.
En chimie, un atome est appel� �lement puisqu'il sert � construire
des mol�cules.
L'�lement est repr�sent� par un symbole caract�ris� par une lettre X.
Ainsi, l'ecriture AZX repr�sente l'�lement X de
masse atomique A et de num�ro atomique Z.
Un atome qui poss�de Z �lectrons poss�de aussi Z protons. Si l'atome perd des
�lectrons, il devient un cation. S'il en gagne, il devient
un anion . Les protons, de charges positives et les �lectrons, de
chrages n�gatives s'attirent mutuellement par des forces �lectrostatiques dites de Coulomb.
Le nombre de protons, dans un atome est �gal au nombre de ses neutrons. Le
nombre de protons ne varient pas. Si le nombre de neutrons est sup�rieur
au nombre de protons au sein d'un atome, on dit que l'atome est un isotope.
Pour un atome, ses isotopes diff�rent du nombre des neutrons.
La taille du noyau (10-15 m�tre) est environ 100 000 fois plus petite que celle de l'atome (10-10 m�tre) et concentre quasiment toute sa masse.
| Constituants de l'atome |
| Constituant |
Symbole |
Charge élecrique (C) |
Masse (kg) |
| Proton |
p |
e= 1,602.10-19 |
mp=1,6726.10-27 |
| Neutron |
n |
0 |
mn=1,6749.10-27 |
| �lectron |
e- |
-1,602.10- 19 |
me=9,1094.10-31 |
Les �lectrons, dans un atome, se logent dans des couches et des sous-couches.
La derni�re couche est dite couche externe ou de valence ou p�riph�rique.
Exemples
Exemple 1:
L'atome d'hydrog�ne est repr�sent� par le symbole H. Il poss�de un proton,
donc Z = 1 et aucun neutron. L'abandance de cet atome est de 99,985 %. On le note
11H.
Son isotope 21H poss�de un proton et un
neutron, donc sa masse atomique est �gale � 2. On note Z =1 et
A = 2. Son abandance est de 0.015 %.
Exemple 2:
L'atome de carbone est repr�sent� par le symbole C. Il
poss�de 6 protons (donc Z = 6), et 6 neutrons. On le note 126C.
Son isotope 146C poss�de toujours 6 protons,
mais 8 neutrons, donc sa masse atomique est �gale � 14. On note Z = 6 et A = 14.
La masse du proton est patiquement �gale � celle du neutron. La masse d'un �l�ctron
est 1836 fois plus petite que celle d'un proton ou d'un neutron. Donc la masse de l'atome est
pratiquement �gale � celle de ses nucl�ons, c'est � dire de son noyau.
Il existe 92 �l�ments chimiques dans la nature, et plus d'une vingtaine d'�l�ments artificiels (transuraniens).
|