Chimie 4:
Les atomes et la
transformation chimique
1. Les atomes
Toute mol�cule est constitu�e de particules microscopiques que l�on appelle atomes.
Il existe diff�rentes sortes d'atomes (plus d�une centaine) qui composent
tous les mat�riaux existant.
Chaque atome est repr�sent� par un symbole qui commence toujours par
une majuscule, parfois suivie d�une minuscule.
La premi�re lettre correspond souvent � la premi�re lettre du nom
Exemples :
| atome |
hydrog�ne |
oxyg�ne |
carbone |
fer |
azote |
chlore |
soufre |
cuivre |
| symbole |
H |
O |
C |
Hg |
N |
Cl |
S |
Cu |
2. Les mol�cules
Des atomes se rassemblent pour former des mol�cules.
2.1. D�finition
Une mol�cule est un regroupement de plusieurs atomes
identiques ou diff�rents li�s entre eux.
2.2. Les formules chimiques
Une mol�cule est repr�sent�e par une formule qui indique:
• les diff�rentes sortes d�atomes dont elle est constitu�e,
(Chaque atome est repr�sent� par son symbole)
• Le nombre de chaque atome
(gr�ce au nombre plac� en indice de chaque atome)
Exemple :
la mol�cule d�eau de formule chimique H2O
- Le symbole H indique que la mol�cule d�eau est constitu�e
d�atomes d�hydrog�ne et son indice indique qu�il y en a deux.
- Le symbole O indique qu�elle est aussi constitu�e d�atomes
d�oxyg�ne mais l�absence d�indice indique qu�il n�y a qu�un atome.
La mol�cule d�eau est donc constitu�e de deux atomes
d�hydrog�ne et d�un atome d�oxyg�ne.
Autres exemples de mol�cules:
La mol�cule de dioxyg�ne a pour formule O2
La mol�cule de diazote a pour formule N2
La mol�cule de dioxyde de carbone a pour formule CO2
La mol�cule de m�thane a pour formule CH4
La mol�cule de monoxyde de carbone a pour formule CO
La mol�cule de butane a pour formule C4H10
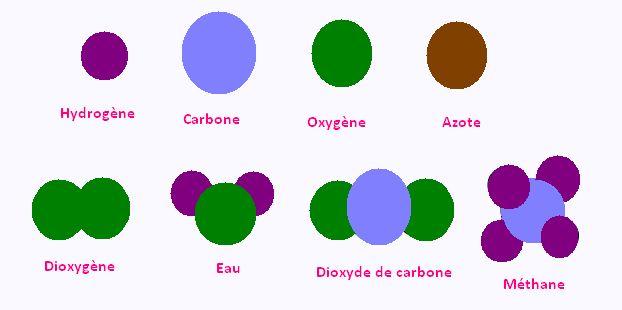
2.3. Les mod�les mol�culaires
Les atomes peuvent �tre mod�lis�s par des sph�res
de couleurs diff�rentes:
Ces sph�res peuvent �tre assembl�es pour mod�liser
des mol�cules
Exemples de mod�les mol�culaires des mol�cules � conna�tre :
3. Les atomes et la transformation chimique
3.1. Les �quations de r�action
L'�quation de r�action est l'ecriture la plus pr�cise
de repr�senter une transformation chimique.
L'�quation de r�action s'�crit � partir de la r�action de transformation o� :
• Les noms des produits et des r�actifs sont remplac�s par leur formule chimique.
• Le principe de conservation de la mati�re doit �tre respect�.
 Principe de conservation de la mati�re:
Principe de conservation de la mati�re:
Le nombre d�atomes de chaque sorte est le m�me avant et apr�s la r�action.
3.2. Exemple1: Equation de r�action de la combustion du carbone
R�action: Carbone + dioxyg�ne → dioxyde de carbone
Equation de la r�action:
C + O2 → CO2
V�rifions que le principe de conservation de la mati�re est respect� :
Avant la transformation
Il y au total : | Apr�s la transformation
Il y a au total : |
| Atomes de carbone: 1 | Atomes de carbone: 1 |
| Atomes d�oxyg�ne: 2 | Atomes d�oxyg�ne: 2 |
Le principe de conservation de la mati�re est respect�:
on dit que cette �quation est �quilibr�e.
Cette �quation se lit:
Un atome de carbone et une mol�cule de dioxyg�ne r�agissent
ensemble pour donner une mol�cule de dioxyg�ne.
3.3. Exemple2: La combustion du m�thane
Bilan : m�thane + dioxyg�ne → eau + dioxyde de carbone
Equation de la r�action (provisoire):
CH4 + O2 → H2O + CO2
Avant la transformation
Il y au total : | Apr�s la transformation
Il y a au total :
| | Atomes de carbone: 1 | Atomes de carbone: 1 |
| Atomes d�oxyg�ne: 2 | Atomes d�oxyg�ne: 1 + 2 = 3 |
| Atomes d�hydrog�ne: 4 | Atomes d�hydrog�ne: 2 |
Cette �quation n�est donc pas �quilibr�e les nombres d'oxyg�ne et d'hydrog�ne
ne sont pas les m�me dans les r�actifs et dans les produits.
Il faut donc ajouter un coefficient devant la formule de certaines
mol�cules afin d�en modifier le nombre.
CH4 + 2 O2 → 2 H2O + CO2
Avant la transformation
Il y au total : | Apr�s la transformation
Il y a au total : |
| Atomes de carbone: 1 | Atomes de carbone: 1 |
| Atomes d�oxyg�ne: 2 x 2 = 4 | Atomes d�oxyg�ne: 2 x 1 + 2 = 4 |
| Atomes d�hydrog�ne: 4 | Atomes d�hydrog�ne: 2 x 2 = 4 |
Cette �quation est maintenant �quilibr�e.
L'�quation de la r�action se lit:
Une mol�cule de m�thane et deux mol�cules de dioxyg�ne r�agissent
ensemble pour donner deux mol�cules d�eau et une mol�cule de dioxyde de carbone.
4. Conservation de la masse
Lors d'une transformation chimique, les atomes des r�actifs se
combinent de mani�res diff�rentes pour former les produits;
mais aucun atome ne dispara�t ou n'appara�t;
donc la masse totale ne change pas.
 Principe de conservation de la masse:
Principe de conservation de la masse:
Lors d'une transformation chimique la masse totale des r�actifs
disparus est �gale � la masse totale de produits form�s.
Exemple
Combustion du carbone:
Carbone + dioxyg�ne → Dioxyde de carbone.
Si 12 g de carbone r�agit avec 32 g de dioxyg�ne alors il se forme:
12 + 32 = 44 g de dioxyde de carbone.
|