Chimie 2: La concentration des réactifs et
la
loi des vitesses de réaction
Voici les facteurs qui influent sur la vitesse
d’une réaction chimique:
- Nature des réactifs
- Concentration des réactifs
- Température
- Catalyseur
- Surface de contact
Nous allons étudier les deux premiers:
La concentration des réactifs et la
loi des vitesses de réaction
L'influence de la concentration des réactifs
sur la vitesse de réaction.
1. Étude théorique:
Lorsqu’on augmente la concentration des réactifs, on
augmente la quantité de molécules qui se trouvent dans
un volume fixe donné.
Ceci a pour effet d’accroître le nombre de collisions entre
les réactifs et d’accélérer la réaction.
Il y a deux moyens d’accroître la
concentration des réactifs:
- Augmenter le nombre de moles de réactifs sans changer le volume.
- Diminuer le volume, dans le cas ou les deux réactifs sont gazeux.
Nous allons considérer le premier cas
pour une étude expérimentale.
Nous allons montrer que la vitesse d’une réaction
augmente avec la concentration des réactifs. La
réaction entre l’acide chlorhydrique HCl
et le Magnésium est plus rapide lorsqu’on utilise de
l’acide concentré au lieu de l’acide dilué.
2. Étude expérimentale:
Nous considérons la réaction de l'acide chlorhydrique
sur le magnésium:
1.2. Protocole expérimental:
1.2.1.Matériel:
Trois éprouvettes de 18x150 mm
Un marqueur non permanent
Un support à éprouvette
Un cylindre gradué de 10 mL
12.5 mL d'eau distillée
17.5 mL d'acide chlorhydrique concentré à 2.0 mol/L
Une balance électronique au millième de gramme
Trois morceaux de 1 cm de ruban de magnésium (Mg)
Un chronomètre.
1.2.2.Manipulations:
1) Identifier les éprouvettes
Éprouvette # 1,
Éprouvette # 2,
Éprouvette # 3 ,
et les déposer dans le support à éprouvettes.
1. Eau distillée
2) À l'aide du cylindre gradué, mesurer 7.5 mL
d'eau distillée et les ajouter dans l'éprouvette #1.
3) À l'aide du cylindre gradué, mesurer 5.0 mL
d'eau distillée et les ajouter dans l'éprouvette #2.
2. Acide chlorhydrique
4) À l'aide du cylindre gradué, mesurer 2.5 mL
d'acide chlorhydrique et les ajouter dans l'éprouvette #1.
2.5 mL (HCl) + 7.5 mL ( eau distillé)
[HCl] = 2 mol/L signifie que 1 L d'HCl contient 2 moles d'HCl.
1 L → 2 mole. Donc:
2.5 mL → 2.5 x (2/1000) = 0.005 moles
Nous avons:
0.005 moles dans (2.5 + 7.5) mL = 0.005/ 10 mL =
0.0005/mL = 0.5 mol/L
[HCl] = 0.5 mol/L
5) À l'aide du cylindre gradué, mesurer 5 mL
d'acide chlorhydrique et les ajouter dans l'éprouvette #2.
5 mL (HCl) + 5.0 mL (eau distillé)
5 mL → 5 x (2/1000) = 0.01 moles
Nous avons:
0.01 moles dans (5 + 5) mL = 0.01/ 10 mL =
0.001/mL = 1 mol/L
[HCl] = 1 mol/L
6) À l'aide du cylindre gradué, mesurer 10 mL
d'acide chlorhydrique et les ajouter dans l'éprouvette #3.
[HCl] = 2 mol/L
7) À l'aide de la balance, peser chacun des
morceaux de magnésium et inscrire les masses obtenues
dans un tableau.
8) Plonger le premier morceau de ruban de magnésium (Mg)
dans l'éprouvette #1 et démarrer le chronomètre.
9) Arrêter le chronomètre lorsque la réaction est terminée et noter le temps de réaction dans le tableau.
10) Répeter l'expérience dans les éprouvettes #2 et #3.
11) Disposer les solutions dans le récipient prévu
à cet effet, nettoyer soigneusement le matériel et
le ranger.
Les résultats:
| Éprouvette | [HCl] (mol/L) | Mg(g) | t(s) |
| #1 | 0.5 | 0.01667 | 529 |
| #2 | 1 | 0.01667 | 90 |
| #3 | 2 | 0.01667 | 30 |
Analyse des résultats:
1. L'équation balancée de la réaction:
Mg(s) + 2 HCl(aq) → H2(g) + MgCl2(aq)
2. Calcul de la vitesse de transformation:
La vitesse de transformation du mganésium est
la quantité de magnésium qui disparait au bout
d'un temps déterminé.
Nous avons:
a) Pour la concentration de 0.5 mol/L d'HCl
0.01667 g de magnésium se transforme en 529
secondes. La vitsse est donc:
v1 = 0.01667 g/529 s = 3.15 x 10 - 5 g/s.
b) Pour la concentration de 1.0 mol/L d'HCl
0.01667 g de magnésium se transforme en 90
secondes. La vitsse est donc:
v2 = 0.01667 g/90 s = 1.85 x 10- 4 g/s.
c) Pour la concentration de 2 mol/L d'HCl
0.01667 g de magnésium se transforme en 30
secondes. La vitsse est donc:
v3 = 0.01667 g/30 s = 5.56 x 10- 4 g/s.
3. Interprétation:
Avec une plus forte concentration d'HCl (2.9 mol/L),
la vitesse de transfornation est plus grande.
Lorsqu’on augmente la concentration des réactifs, on
augmente la quantité de molécules qui se trouvent dans
un volume fixe donné.
Ceci a pour effet d’accroître le nombre de collisions entre
les réactifs et d’accélérer la réaction.
4. Causes d'erreurs:
Les mesures des masses sont assez précises.
Les erreurs proviennent des mesures en mL de
la quantité d'HCl versée dans les éprouvettes.
Elles proviennent également de la mesure du temps
sur le chronomètre.
Les erreurs faites pendant ses mesures influencent sur
les résultats pour donner des valeurs approximatives.
Conclusion
1. La réaction entre l’acide chlorhydrique HCl
et le Magnésium est plus rapide lorsqu’on utilise de
l’acide concentré au lieu de l’acide dilué.
D'une façon générale, compte tenu des résultats théoriques,
la vitesse d’une réaction augmente avec la concentration
des réactifs.
2.
Une variation de la concentration, change l'allure
de la coube de distribution de Maxwell.
Une augmentation de la concentration donne une courbe
plus haute. Ceci augmente le nombre de molécules avec
des collisions efficaces .
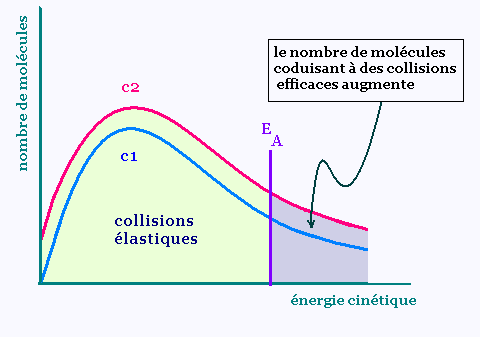
Cette courbe représente la répartition de l'énergie
cinétique des molécules de réactifs à deux concentrations
différentes c1 et c2.
La concentration c1 est la plus faible. Lorsqu'on augmente le nombre
de molécules, la concentration devient plus élevée.
La vitesse de réaction est plus élevée pour une plus
forte concentration, due aux collisions.
|