Chimie 2: La nature des réactifs
L'influence de la nature des réactifs
sur la vitesse de réaction
L'influence de la nature des
réactifs
sur la vitesse de réaction
1. Les bus de l'éxpérience
- Déterminer expérimentalement l'influence de la nature des réactifs
sur la vitesse de réaction
- Expliquer l'influence de la nature des réactifs
sur la vitesse de réaction à l'aide de la théorie
des collisions.
2. L'hpothèse: Étude théorique:
On doit considérer les 2 aspects suivants :
1) La vitesse d’une réaction chimique est plus rapide selon
la nature des réactifs suivant l'ordre: ionique en milieu
aqueux, état gazeux, liquide, et état de solide.
2) Plus le nombre de liaisons à briser (atomisation)et à former
(molécularisation) est élevé, plus la réaction sera lente.
3) Plus l'énergie d'activation des réactifs est faible,
plus la réaction est rapide.
4) Plus il y a de liaisons à briser, plus la réaction est lente. Et
Plus les liaisions sont fortes, plus la réaction est lente également;
tout en considérant que les liaisons covalentes sont d'autant plus
fortes quand on passe des simples au double et au triples.
3. Étude expérimentale:
Nous considérons les réactions d'oxydationde l'acide
oléique C18H34O2 et de l'acide stéarique C18H36O2 en
présence du peroxyde d'hydrogène H2O2.
4. Protocole expérimental:
4.1. .Matériel:
Une éprouvette de 18 x 150 mm
Un bouchon en caoutchouc
Un support à éprouvettes
Un cylindre gradué de 10 mL
Une balance
Une bouteille compte goutte contenant du peroxyde
d'hydrogène concentré à 3%
2 mL d'une solution d'acide oléique
concentré à 0.16% dans l'alcool
2 mL d'une solution d'acide stéarique
concentré à 0.16% dans l'alcool
Une balance
Un chronomètre.
4.2. Manipulations:
- À l'aide de la balance, peser l'éprouvette vide avec le bouchon,
- À l'aide du cylindre gradué mesure 2 L d'acide oléique,
le verser dans l'éprouvette et mettre le bouchon,
- À l'aide de la balance, peser l'éprouvette contenant l'acide
oléique,
- Au moment de démarrer le chronomètre, ajouter
3 gouttes de peroxyde d'hydrogène et remettre le ouchon
- Cesser de chronométrer lorsque le précipité
cesse d'apparaître dans la solution,
- Noter le temps de réaction,
- Vider la solution dans le bac de récupération,
nettoyer et ranger.
- Reconmmencer l'expérience pour l'acide stéarique.
5. Résultats
5.1 Tableaux
| nature des acides gras | masse éprouvette vide + bouchon (g) |
masse éprouvette + acide + bouchon (g) | masse acide gras |
| acide oléique | 19.48 | 20.89 | 1.41 |
| acide stéarique | 19.45 | 20.88 | 1.43 |
| nature des acides gras | temps de réaction (s) |
| acide oléique | 3.52 |
| acide stéarique | 4.0 |
Analyse des résultats
5.2. Calcule des vitesses de réactions
On suppose que les réactions sont complètes, on calcule la vitesse de
réaction des deux solutions.
vitesse de réaction v = (masse transformée du réactif)/(temps de réaction)
v (oléique) = 1.41/3.52 = 0.4 g/s
v (stéarique) = 1.43/4.0 = 0.37 g/s
5.3. Interprétations
La réation de l'acide oléique prend moins de temps
(t = 3.52 s) que celle de l'acide stéarique
(t = 4.0 s). Ainsi pour une même masse transformée (1.4 g), la
vitesse de réaction de l'acide est plus grande que celle de
l'acide stéarique
5.4. Utilisation des formules structurales
des molécules
Selon les formules structurales
des molécules des deux acides gras, on remarque la
différence suivante:
- L'acide oléique possède une liaison double C=C
d'energie = 602 kJ/mol.
- L'acide stéarique possède une liaison simple C-C
d'energie = 348 kJ/mol et deux liaisons C-H
d'energie 413 kJ/mol chacune; soit une energie
de 1174 kJ/mol.
Ainsi l'energie de l'acide stéarique est
de 1174 - 602 = 572 kJ/mol de plus que celle
de l'acide oléique. La vitesse de réaction de
l'acide stéarique est plus petite, puisqu'il
lui faut plus de temps d'arrager ses molécules.
5.5. Causes d'erreurs:
Les erreurs proviennent des mesures en mL des
volumes des liquides utilisés versées dans
le cylindre gradué, ainsi que les mesures de mass sur
la balance.
Elles proviennent également de la mesure du temps
sur le chronomètre.
Les erreurs faites pendant ses mesures influencent sur
les résultats pour donner des valeurs approximatives.
Conclusion
6. Nature des réactifs et vitesse de réaction
La nature des réactifs influence aa vitesse d’une
réaction chimique. La réaction se fait lentement
lorsque le nombre de liaisons à briser et à former
est élevé, plus la réaction sera lente. Ainsi plus
l'énergie d'activation des réactifs est grande,
plus la réaction est lente.
7. Courbe de distribution de Maxwell
Lorsque l'énergie d'activation des réactifs est garnde,
plus la réaction se fait lentement. Pour produire des collisions
efficaces, cette energie d'activation doit être
plus élevée.
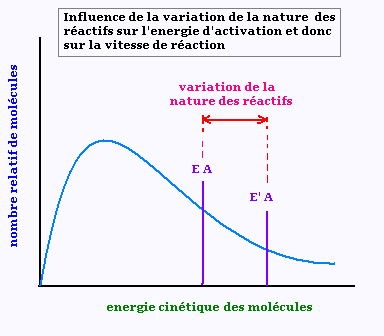
Dans la courbe de distribution de Maxwell, une variation
de la nature des réactis produirait une variation de
l'energie d'activation. Cela produirait une variation
du nombre de molécules produisant des collisions efficaces .
|