Chimie au cegep
Chimie & petrochimie
Chimie & laboratoires
© The scientific sentence. 2010
| |
|
Chimie 2: Chimie des solutions
Masse volumique et densité
Masse molaire et concentration molaire
Loi d'avogadro et nombre d'avogadro
Solubilité et solution saturée
1. Rappels
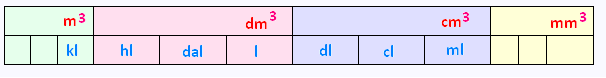
• Conversions des capacités :
• Les CNTP :
Les conditions normales de température et de pression (CNTP)
sont celles où: la température est de 0oC ou 273 K et
la pression est de 101.3 kPa ou 1 atm.
• Les CTAPN :
Les conditions de température ambiante et pression normale (CTAPN)
sont celles où: la température est de 25oC ou 298 K et
la pression est de 101.3 kPa ou 1 atm.
• Loi d'avogadro :
Dans les CNTP, le volume molaire de n’importe quel gaz
est égal à 22.4 L.
Dans les CTAPN, le volume molaire de n’importe quel gaz
est égal à 22.5 L.
• La masse volumique d'une substance :
La masse volumique d'une substance est le rapport d'une masse de cette
sunstance et son volume correspondant. On la note ρ ;. Elle s'ecrit:
ρ = m / V
, où
ρ représente la masse volumique,
m représente la masse (g), et
V représente le volume (ml ou cm3)
• Qu'est-ce qu’une solution saturée :
Une solution saturée est une solution dans laquelle la quantité de soluté déjà dissous est telle qu’on ne peut plus y dissoudre de soluté supplémentaire: toute quantité supplémentaire formera un dépôt.
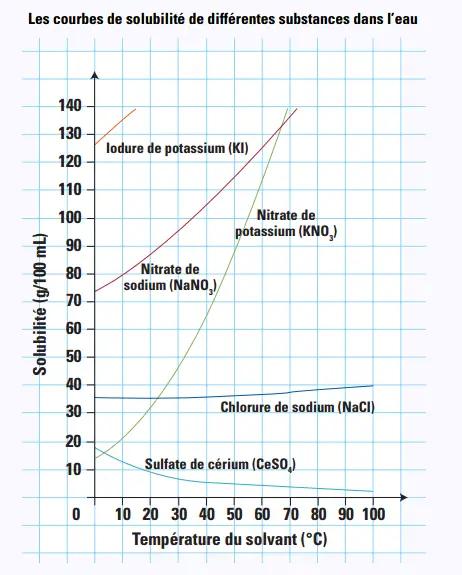
• Qu'est-ce que la solubilité :
La solubilité désigne la quantité maximale de soluté pouvant être dissoute dans un volume donné de solvant à une température donnée.
En général, la solubilité des solides augmente avec la température`à l'exception
due sulfate de cérium (CeSO4).
Exemple: Si on peut dissoudre un maximum de 5 g de soluté en poudre dans 25 mL d’eau à 25 °C, la solubilité de cette substance, exprimée en g/100 mL, est de 20 g/100 mL.
• La concentration môlaire :
La concentration môlaire, ou môlarité, ou parfois taux molaire d'une espèce chimique,
est sa quantité de matière, exprimée en moles par unité de volume.
La concentration molaire d'une espèce X est notée c ou [X].
La concentration molaire c du soluté s'ecrit:
c = n / V
, où
c représente la concentration molaire ,
n représente le nombre de moles (mol) du soluté, et
V représente le volume (ml ou cm3) de la solution.
2. Mélange de gaz

L'air est composé , en volume, d'environ 80% de diazote (N2) et 20% de dioxygène
(O2) .
a) Une salle de 50 m3 contient donc un volume de N2 =
(80/100) x 50 = 40 m3 un volume de O2 = (20/100) x 50 = 10 m3.
b) Dans les CNTP, selon la loi d'Avogadro, le volume molaire de chaque gaz est de
24.0 L = 24.0 dm3 = 0.024 m3.
Ainsi
| 0.024 m3 de tou gaz |
→ |
1 mole |
| 40 m3 de N2 |
→ |
? |
| 10 m3 de O2 |
→ |
? |
Un produit croisé donne:
| 40 m3 de N2 |
→ |
40 x (1 mole)/0.024 =
1666.67 moles de N2 |
| 10 m3 de O2 |
→ |
10 x (1 mole)/0.024 =
416.67 moles de O2 |
c) D'après la table périodique des éléments O = 16 g/mol et
N = 14 g/mol. Donc O2 = 32 g/mol et N2 = 28 g/mol.
On convertit les moles en masse por chcun de ces deux gaz:
| 1 mole (N2) |
→ |
28 g |
| 1 mole (O2) |
→ |
32 g |
Donc
| 1666.67 moles de N2 |
→ |
1666.67 x 28 =
46666.76 g de N2 |
| 416.67 moles de O2 |
→ |
416.67 x 32 =
13333.44 g de O2 |
d) La masse de l'air de la salle est la somme des masses des
deux principaux constituants = 46666.76 + 13333.44 = 60000.2 g =
60 kg.
Ce résultat peut être vérifié en utilisant la masse volumique de l'air.
Dans les CNTP, la masse volumique de l'air est égale à 1.292 kg/m3.
Donc un volume de 50 m3 d'air pèse 1.292 x 50 ≈ 65 kg.
3. Masse volumique
Un flacon contient 0.25 L de gaz propane C3H8 dans des conditions telles que
sa masse volumique est de 1.8 g/L.
a)
| 1 L |
→ |
1.8 g |
| 0.25 L |
→ |
1.8 x 0.25 = 0.45 g |
Le flacon contient ume masse de propane égale à 0.45 g .
b) Masse molaire du propane = (3 x 12) + (8 x 1) = 36 + 8 = 44 g
Masse molaire du propane = 44 g .
c)
| 44 g |
→ |
1 mole de C3H8 |
| 0.45 g |
→ |
0.45/44 = 0.01023 moles |
La quantité de matière de propane dans le flacon est 0.01023 moles .
d)
| 0.01023 moles |
→ |
0.25 L |
| 1 mole |
→ |
0.25/0.01023 = 24.44 L |
Le volume molaire du propane est 24.44 L .
Un flacon contient 0.25 L de gaz méthane CH4 dans des conditions telles que
sa masse volumique est de 0.67 g/L.
a)
| 1 L |
→ |
0.67 g |
| 0.25 L |
→ |
0.67 x 0.25 = 0.1675 g |
Le flacon contient ume masse de méthane égale à 0.1675 g .
b) Masse molaire du méthane = (1 x 12) + (4 x 1) = 12 + 4 = 16 g
Masse molaire du propane = 16 g .
c)
| 16 g |
→ |
1 mole de CH4 |
| 0.1675 g |
→ |
0.1675/16 = 0.0105 moles |
La quantité de matière de méthane dans le flacon est 0.0105 moles .
d)
| 0.0105 moles |
→ |
0.25 L |
| 1 mole |
→ |
0.25/0.0105 = 23.81 L |
Le volume molaire du méthane est 24.0 L .
4. Concentration
On prépare 200 mL d'une solution d'eau sucrée en dissolvant dans l'eau
deux morceaux de sucre (saccharose C12H22O11).
Ces deux norceaux de sucre sont pris d'une boîte d'un kilogramme contenant
trois couches de quatre rangées de quinze morceaux de sucre chacune.
Parallèlement, on prépare 200 mL d'une solution d'eau sucrée, de même gout sucré
que la première, en dissolvant dans l'eau de l'aspartame
(C14H18N2O5).
La solution d'aspartame est 220 fois moins concentrée que celle de sucre.
Soit cs la concentraction du sucre = masse de sucre/200 mL
masse de sucre = masse de deux morceaux = 2 x 1kg/(3 x 4 x 15) = 0.0111 kg =
11.10 g.
Donc cs = 11.10g/200 mL
Soit ca la concentraction d'aspartame = masse d'aspartame /200 mL
On a ca = cs/220 . Donc masse d'aspartame /200 = cs/220
masse d'aspartame = 200 x cs/220 = 200 x (1/220) x 11.10/200 =
(1/220) x 11.10 = 0.050 g = 50.0 mg
50.0 mg d'aspartame est équivalent à 11.10 g de sucre .
5. Vinaigre
Un vinaigre à 8 degré est une solution acqueuse
contenant essentiellement, en plus du solvant,
de l'acide éthanoique C2H4O2.
L'appellation « vinaigre à 8o» signifie
que dans 100 mL de solution, il y a 8.0 mL de cet
acide.
a) La masse molaire de l'acide éthanoïque est égale à
(2 x 12) + (4 x 1) + (2 x 16) = 60 g.
b) La mass volumique de l'acide éthanoique est de 1.05 g/cm3.
| 100 mL (solution) |
→ |
8.0 mL (acide) |
| 1 L (solution) |
→ |
80.0 mL (acide) |
1 cm3 = 1 mL, ρ (acide) = 1.05 g/cm3. Donc
1 mL correspond à 1.05 g. D'où 80.00 mL correspond à 80.00 x 1.05 = 84 g.
Il y a 84 grammes d'acide éthanoique dans un litre de vinaigre à
8o.
c) La quantité de matière d'acide éthanoique
Dans un litre de vinaigre nous avons 84 g d'acide éthanoique. Une mole
d'acide éthanoique (C2H4O2) pèse
(2 x 12) + (4 x 1) + (2 x 16) = 24 + 4 + 32 = 60 g.
| 60 g (acide éthanoique) |
→ |
1 mole |
| 84 g (acide éthanoique) |
→ |
84/60 = 1.4 moles |
Il y a 1.4 moles d'acide éthanoique dans un litre de vinaigre à
8o.
La concentration molaire d'acide éthanoique à
8o est de 1.4 mol/L.
6.Ammoniac
L'ammoniac NH3 est un gaz très sluble dans l'eau.
On se place dans les CNTP.
a) On prépare une solution d'ammoniac de 5.0 L
par dissolution de 1.2 L d'ammoniac dans l'eau.
Dans les CNTP,
| 24.0 L (NH3) |
→ |
1 mole |
| 1.2 L (NH3) |
→ |
1.2/24 = 0.05 moles |
La concentration molaire de la solution
d'ammoniac est 0.05/5 = 0.01 moles/L .
b) La masse molaire de l'ammoniac est égale à (1 x 14) + (3 x 1) = 17 g/mol.
| 1 mole (NH3) |
→ |
17 g (NH3) |
| 0.01 mole (NH3) |
→ |
0.01 x 17 = 0.17 g |
0.17 g d'ammoniac est dissoute dans 1 L de solution .
c)
Pour une concentration de 0.20 mol/L = 0.10 mol/500 mL, il faut 0.10 moles, c'est à
dire 0.10 x 24.0 L = 2.4 L.
2.4 L de gaz ammoniac sont necéssaires pour fabriquer
500 mL de molarité de 0.20 mol/L .
7. Évaporation
On dispose de 500 mL d'eau sucrée de concentration molaire
égale à 0.050 mol/L.
a) Par évaporation partielle d'eau, le volume de la solution est
réduit à 450 mL.
| 1 L |
→ |
0.050 mol |
| 500 mL |
→ |
0.050/2 = 0.025 mole |
La nouvelle concentration molaire est égale
à : 0.025 mole/450 mL = 0.025 mol/0.450 L
0.055 mol/L. .
b) Après évaporation totale de l'eau, il restera 0.025 mole de saccharose
(C12H22O11). Ceci correspond à une masse de 0.025 x d'une mole de saccharose =
0.025 x (12 x 12 + 22 x 1 + 11 x 16) = 0.025 x 342 = 8.55 g.
Il restera 8.55 g de saccharose après évaporation totale de l'eau .
c) À la température ambiante (25o), la solubilité du saccharose
est de 2 kg/L environ.
| 342 g (saccharose) |
→ |
1 mole |
| 2 kg (saccharose) |
→ |
2000 /342 = 5.848 moles |
La concentration molaire d'une solution saturée de sucre est donc de
5.85 mol/L.
d)
On ne dispose que de 0.025 mol de saccharose.
À saturation,
| 5.85 moles |
→ |
1 L |
| 0.025 mole |
→ |
0.025/5.85 = 0.00427 L = 4.27 mL |
À saturation, le volume de la solution qui reste après
évaporation est de 4.27 mL .
8. Mélange de solutions
On mélange 250 mL d'une solution d'acétone (C3H6O) de concentration molaire
0.500 mol/L et 250 mL d'une solution d'acétone fabriquée à partir de 23.3 g
d'acétone.
Une mole d'acétone pèse (3 x 12) + (6 x 1) + (1 x 16) = 36 + 6 + 16 =
58 g.
| 1 L |
→ |
0.500 mole |
| 250 mL |
→ |
0.25 x 0.50 = 0.125 mole |
| 58 g (acétone) |
→ |
1 mole |
| 23.3 g (acétone) |
→ |
23.3/58 = 0.402 mole |
a)
La solution mélangée obtenue a un volume de 250 + 250 = 500 mL et
une quantité de matière de 0.125 + 0.402 = 0.527 mole.
Nous avons donc 0.527 mole dans 500 mL. La concentration molaire de la solution
obtenue est donc 0.527 mole/500 mL = 1.05 mol/L.
La concentration molaire de la solution
obtenue est égale à 1.05 mol/L .
b) 23.3 g d'acétone correspond à 0.402 mole.
Un litre de solution d'acétone de concentration molaire
0.500 mol/L contient 0.500 mole.
Introduire 23.3 g d'acétone dans un litre de solution d'acétone de
concentration molaire 0.500 mol/L revient , après agitation,
à mélanger (0.402 + 0.500) = 0.902 mole d'acétone dans 1 litre
de solution. La concentraction molaire est donc 0.902 mole/litre.
La concentraction molaire du nouvau méalange est 0.902 mol/L
.
|