Chimie:
La concentration en ppm
(parties par millions)
1. Définition
On mesure la concentration d'un soluté dans une solution
en g/L. Lorsque les quantités de soluté sont très petites
dans une grande quantité de solution, on mesure plutôt
la concentration en ppm (Parties Par Millions).
2. L'unité des ppm
La concentration en ppm se mesure en g de soluté par millions de grammes
de solution, soit g/Mg.
1 ppm = 1g (de soluté)/1 000 000 g (de solution)
1 ppm = 1g (de soluté)/1 000 000 mL (de solution)
On mesure aussi les ppm en milligramme/kilogramme ou pour
s'en rappeler facilement en kg/Mkg et kg/ML
On note: M = Million = Méga = 1000 000 = 106
• 1 ppm = 1 kg/Mkg
• 1 ppm = 1 kg/ML
3. Exemple
La concentration actuelle de dioxyde de carbone (CO2) présent
dans l’atmosphère terrestre est de 400 parties par millions (ppm).
Cela signifie que dans 1 million de litres d'air, il y a 1 kilogramme
de dioxyde de carbone ou dans 1000 litres d'air, il ya un gramme de CO2.
4. Exercices résolus
Exercice 1
On a mesuré la quantité de polluants émis dans l'eau au bord d'un lac.
Sur 250 L d'eau prélevés, on retrouve 45 mg de polluants.
Quelle est la concentration de polluants en ppm au bord
du lac?
Réponse:
Soluté = 45 mg de polluants
Solution = 250 L d'eau
Concentration = 45 mg/ 250 L = 0.045 g/ 250 000 mL =
4.5 g/ 25 000 000 mL = 4.5/25 (g/MmL) = 4.5/25 ppm = 0.18 ppm.
La concentration de polluants est de 0.18 ppm
Exercice 2
Quelle est le volume d'une solution contenant 50.00 ppm
de 18 g de soluté.
Réponse:
18 / x = 50.00 ppm
x = 18/50 = 18 (g) /50 (g/M mL) = 0.36 M mL =
360 L
Le volume de solution de 18 g de soluté de comcentration 50.00 ppm
est de 360 L.
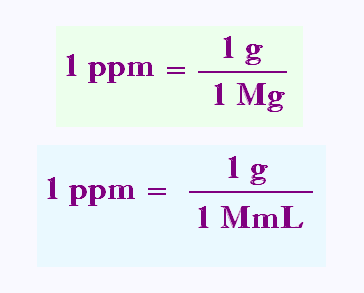
|