Chimie 2: Enthalpie d'une réaction chimique
1. Définition
L’enthalpie d’une molécule est l''énergie
interne de la molécule . C'est l'énergie
requise pour former ou briser cette molécule.
Elle est représenté par le symbole H.
Au cours d'une réaction chimique, les
molécules se transforment et leurs enthalpies
changent. Les réactifs deviennent
produits. La différence entre l’enthalpie
des produits et celle des réactifs est appelée
variation d’enthalpie d’une réaction chimique.
Cette variation est représentée par l’expression
ΔH H(Pruits) - H(reactifs).
Réactifs → Produits
2. Réaction éxothermique et endothermique
Réaction éxothermique: Chaleur dégagée
H(Réactifs) = H(Produits) + ΔH
- ΔH = H(Produits) - H(Réactifs)
ΔH(réaction) = H(Produits) - H(Réactifs) < 0
Réaction endothermique: Chaleur fournie
H(Réactifs) + ΔH = H(Produits)
ΔH = H(Produits) - H(Réactifs)
ΔH(réaction) = H(Produits) - H(Réactifs) > 0
3. L'enthalpie d'une réaction
Pour évaluer une réaction chimique du point de vue
energétique, on calcule l'enthalpie de la réaction
ΔH(réaction).
Les valeurs des enthalpies sont données dans les tables
d'enthalpie. Pour travailler avec les valeures des tables,
en utilise les deux règles suivantes :
1- L'enthalpie de réaction pour briser un lien chimique
est toujours égale à celle de la formation du même
lien chimique dans un composé.
2- On indique par un
+ l'enthalpie ajoutée pour
briser des liens chimiques des réactifs, et par un
– l'enthalpie perdue due à
la formation des liens chimique des produits.
4. Exemple
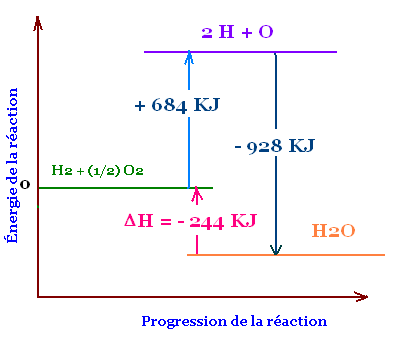
Enthalpie de réaction de la synthèse de l’eau.
Réaction : H2(g) + 1/2 O2(g) → H2O(g)
H - H + 1/2 (O - O) → H2O
Liens brisés:
H - H = + 435 KJ
1/2 x ( O - O) : (1/2) ( + 498) = + 249 KJ
Énergie totale absorbée : + 684 KJ
Formation de liasions :
2 x (O - H) : 2 x (- 464) = - 928 KJ
Énergie totale dégagée : - 928 KJ
Bilan de la réaction :
Énergie de la réaction = Énergie absorbée + Énergie dégagée
+684 KJ + - 928 KJ = - 244 KJ/mol,
La réaction est exothermique.
Diagramme energétique
|