Chimie: Réaction entre le fer et l'acide chlohydrique
1. La composition de l'acide chlorhydrique
Comme son nom l'indique l'acide chlorhydrique est une solution acide.
Une mesure de pH le confirme en indiquant un pH nettement inférieur à 7.
L'acidité d'une solution est liée à la présence des ions hydrogène H+.
Le terme chlorhydrique dérive de chlore et peut laisser penser que des ions chlorures
sont également présents dans cette solution.
Pour le confirmer il suffit de réaliser le test de reconnaissance des ions chlorure:
On ajoute quelques gouttes de nitrate d'argent qui conduisent à la formation
d'un précipité de couleur blanche qui noircit à la lumière et indique que le
test est positif.
L'acide chlorhydrique contient bien des ions chlorure.
L'acide chlorhydrique est une solution qui contient des ions hydrogènes H+
et des ion chlorure Cl-.
2. Réaction entre le fer et l'acide chlohydrique
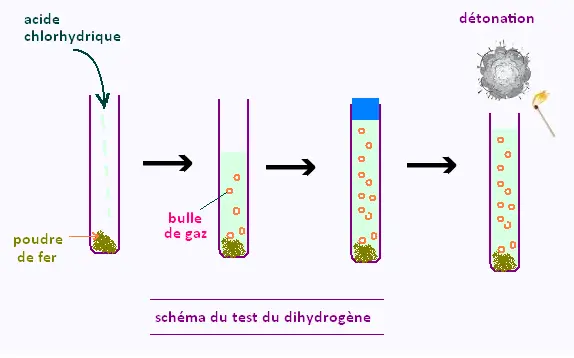
On réalise l'expérience qui a pour objectifs:
• D'identifier les produits de la transformation chimique
lorsque le fer est mis en contact avec de l'acide chlorhydrique.
• D'ecrire la réaction chimique qui traduit cette transformation
chimique.
On utilise:
- du fer en poudre car c'est à l'état divisé qu'il est le plus réactif.
- une solution d'acide chlorhydrique assez concentrée.
- un tube à essais permettant une meilleure observation.
On observe l'apparition de bulles qui représentent un gaz.
On doit donc identifier ce gaz et analyser la composition du mélange.
On bouche le tube avec un bouchon adapté. Après avoir laissé le gaz
se dégager assez longtemps pour s'accumuler dans le tube
on approche une flamme et on ouvre le bouchon.
on entend alors une petite détonation qui permet de conclure que ce gaz
est bien du dihydrogène.
3. Identification du dihydrogène
On veut s'assurer que le gaz produit lorsque le fer est en
contact avec de l'acide chlorhydrique est du dihydrogène.
Le dihydrogène est un gaz incolore, inodore, non toxique.
Il est également beaucoup moins dense que l'air. Il constitue avec le dioxygène
de l’air un mélange tonnant qui peut exploser à la moindre flamme ou étincelle.
Le dihydrogène possède donc une caractéristique dangereuse: il est inflammable.
Il était autrefois utilisé dans les ballons dirigeables mais il a été remplacé
par l'hélium a cause de sa caractéristique dangereuse.
Comme toutes les combustions, la réaction du dihydrogène avec
le dioxygène peut être soit progressive se faisant avec une flamme,
soit explosive.
On note que, le fait de boucher le tube pendant un certain temps, où se produit
le dégagement gazeux du dihydrogène, on créée les conditions pour une combustion
explosive. En tout cas, Il faut bien manipuler avec soin.
4. Transformations et réactions chimiques
Pour découvrir les phénomènes qui se sont produits au contact du fer et
de l'acide chlorhydrique, on analyse analyse la solution obtenue:
• Une mesure de pH montre que ce dernier à augmenté: la solution est moins acide
donc des ions hydrogène ont été consommés.
• L'ajout de nitrate d'argent conduit à la formation d'un précipité blanc qui
indique les ions chlorure sont toujours en solution.
• Le test de reconnaissance des ions fer (II) est positif: des ions Fe2+ sont apparus.
Puisque des composés chimiques ont disparus et que d'autres sont apparus on peut
en conclure qu'il y a bien eu une transformation chimique.
• Les réactifs sont les substances mises en présence: le fer et l'acide chlorhydrique.
• Les produits sont les substances qui sont apparues: le dihydrogène ainsi que les ions
fer II qui forment avec les ions chlorure une solution de chlorure de Fer (II)
Cette transformation chimique peut être traduite par l'écriture d'une réaction chimique:
fer + acide chlorhydrique → dihydrogène + chlorure de fer (II)
|