Chimie 2:Les ions
Formations
Formation des ions monoatomiques
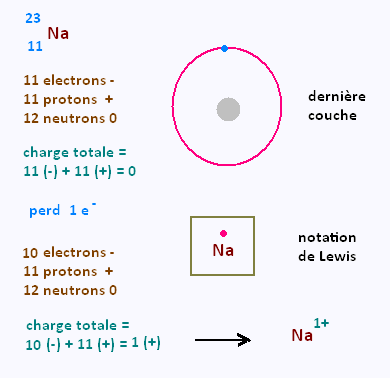
Un atome est électriquement neutre (le nombre de protons + est égal au nombre des électrons -).
Un ion est un atome qui a gagné ou qui a perdu un ou des électrons
Tout atome a la possibilité soit de perdre ou de gagner des électrons.
Il a aussi la possibilité soit de vider, soit de remplir totalement sa
dernière couche (Règle de l’octet ou du duet pour l'hydrogène).
Un atome qui a perdu ou gagné un ou plusieurs électrons est un
ion. Un cation lorsqu'il gagne un ou plusieurs
électrons, et un anion lorsqu'il en perd.
Les ions peuvent se présenter sous forme
d'un seul atome chargé, se sont des ions monoatomiques.
Sous forme d'une molécule chargé, ils sont
appelés ions polyatomiques ou radicaux.
1. Ions monoatomiques
Voici une méthode permettant de déterminer la charge d'un ion monoatomique.
Elle ne mmarche, cependant que pour les éléments dont le numéro atomique
est inférieure à 40, excluant également les éléments de transition.
l'exemple du sodium:
Nous avons le tableau des chrages suivants:
| Colonnes |
I |
II |
ET |
III |
IV |
V |
VI |
VII |
VIII |
| Nombre
d'électrons de valence |
1 |
2 |
* |
3 |
4 |
5 |
6 |
7 |
8 |
| Charges de l'ion |
1+ |
2+ |
* |
3+ |
* |
3- |
2- |
1- |
0 |
ET: Éléments de transistion.
On remarque que le carbone ne forme pas d'ions.
Exercices
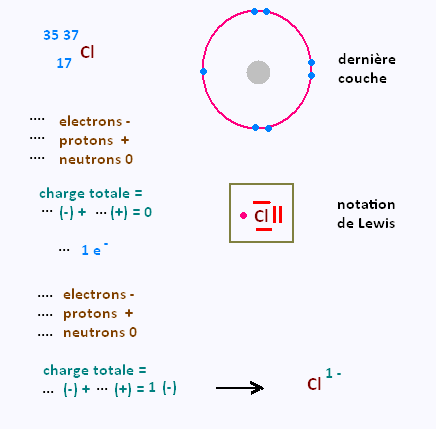
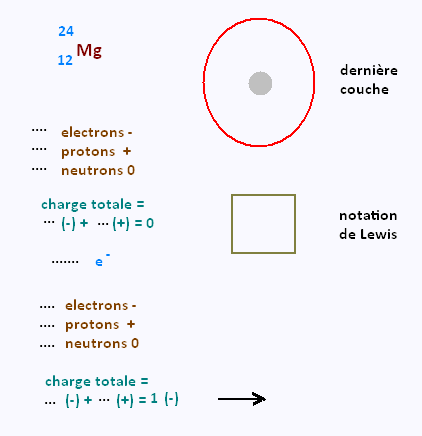
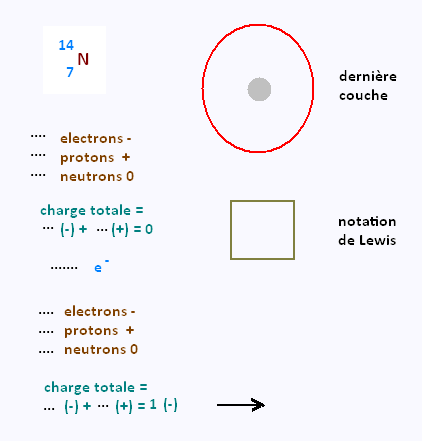
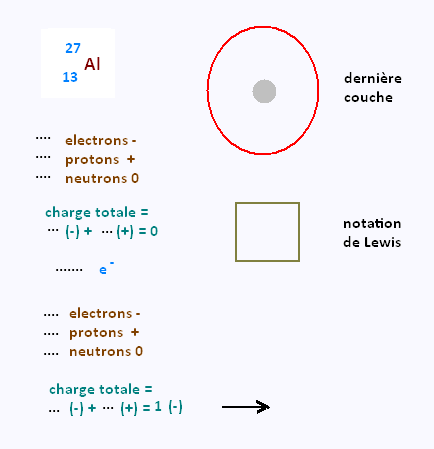
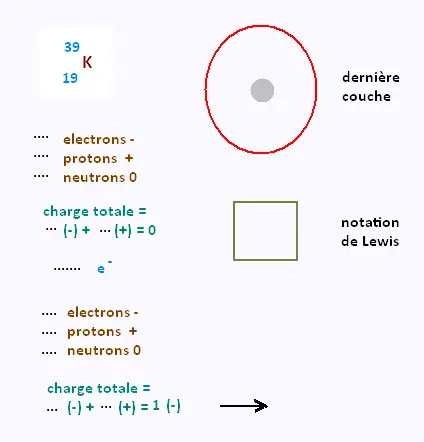
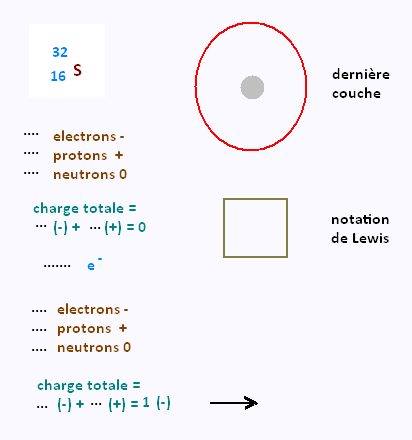
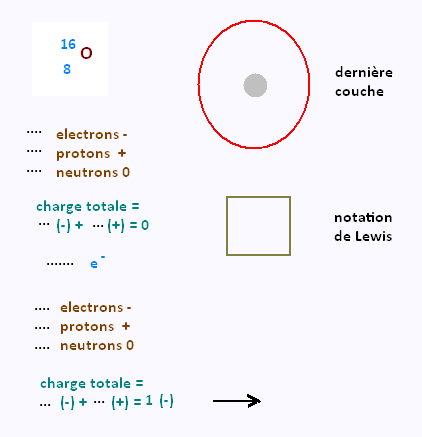
Déterminer selon la méthode précédente la charge
des ions suivants:
|