Chimie 2: Transformation du jus de raisin
1. La réaction
La réaction transforme le sucre C2H12O6
contenu dans le jus de raisin em éthanol C2H5OH et
en dioxyde de carbone CO2 suivant l'équation balancée suivante:
C2H12O6 (aq)
→
2 CcH5OH (aq) +
2 CO2 (g)
2. La masse de l'éthanol obtenue
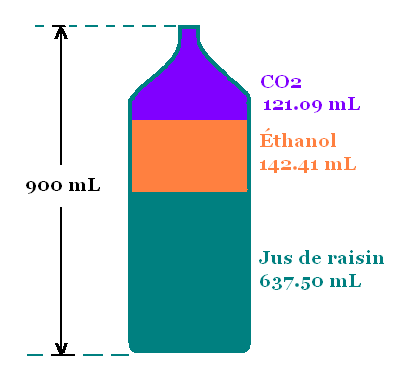
750 mL de jus de raisin dans une bouteille de 900 mL.
La masse volumique ρ d'une substance est égale au rapport de
sa masse m et de son volume V:
Donc ρ = m/V
On en déduit la masse m = ρ x V
La masse volumique du jus de raisin est ρJR = 1.0 g/mL .
Son volume initial est V = 750 mL. Donc sa masse initiale
mJR = ρJR x V = 1.0 (g/mL) x 750 (mL) = 750 g.
15% de cette masse initiale mJR du jus de raisin est transformée
en éthanol. Donc la masse d'éthanol obtenue est de :
mET = 15% x 750 g = 15 x 750 /100 g = 112.50 g.
mET = 112.50 g
3. Les moles de CO2
La masse molaire de l'éthanol C2H5OH est
MET = (2 x 12) + (1 x 5) + 16 + 1 = 46.00 g.
Donc 46.00 g de C2H5OH → 1 mole de C2H5OH,
mET = 112.50 g de de C2H5OH
Donc
112.50/46.00 moles =
2.45 moles de C2H5OH
D'après la réaction on a:
2 moles de C2H5OH → 2 moles de CO2 , c'est
à dire
1 mole de C2H5OH → 1 moles de CO2
Et donc:
2.45 moles de C2H5OH → 2.45 moles de CO2.
2.45 moles de CO2
4. Volume du CO2 dans la bouteille
On a ρ = m/V , donc m = ρ V.
Ainsi, pour une substance donnée, la masse est
proportionnelle au volume.
15% de la masse initiale du jus de raisin, c'est aussi
15% de son volume.
Pour le volume initial 750 mL du jus de raisin, 15% est transformé en
éthanol. Il reste donc un volume de
750 - (15% x 750) = 85% x 750 mL =
637.50 mL de jus de raisin.
VJR = 637.50 mL
La masse d'éthanol obtenue est mET = 112.50 g
La masse volumique de l'éthanol est 0.79 g/mL
Donc 0.79 = mET/VET
VET = mET/0.79 = 112.50/0.79
= 141.41 mL
VET = 141.41 mL
Le volume qui reste est occupé par le
dioxyde de carbone CO2
VCO2 + VET + VJR = 900 mL
Donc
VCO2 = 900 mL - VET - VJR =
900 mL - 141.41 mL - 637.50 mL = 121.09 mL =
0.121 L.
Le volume du gaz CO2 occupant la partie suppérieure de
la bouteille est VCO2 = 0.121 L = 0.121/1000 m3 =
0.000121 m3 .
VCO2 = 0.000121 m3
5. Pression du dioxyde de carbone dans la bouteille
On suppose que le dioxyde de carbone CO2 est un gaz
parfait:
La loi des gaz parfait s'ecrit:
PV = n R T
p est la pression du gaz (en pascal),
V est le volume occupé par le gaz (en mètre cube),
n est la quantité de matière (en mole),
R est la constante universelle des gaz parfaits :
R = 8,314 (J/K)/mol,
T est la température absolue (en kelvin),
Tk = Tc + 273.15
avec :
Tk la température en Kelvin,
Tc la température en °C.
Donc P = n RT/V
On a:
P = 2.45 x 8,314 (25 + 273.15)/0.000121 = 50190965.26 pascals
P = 495.38 atmospheres
PCO2 = 50190965.26 pascals = 495.38 atmospheres
|