Chimie:
Les transformations chimiques
Je confirme mes acquis
Les transformations chimiques
1. La loi de la conservation de la masse
1. Décrire brièvement la loi de la conservation de
la masse.
Selon la loi de la conservation de la
masse, dans une transformation chimique, la masse
totale des réactifs est toujours égale à la masse
totale des produits.
2. La synthèse de l’ammoniaque se réalise selon
l’équation suivante :
N2 (g) + 3 H2 (g) → 2 NH3 (g)
Si l’on fait réagir 56 g de diazote (N2) avec le
dihydrogène (H2) et que 68 g d’ammoniaque (NH3) sont produits,
quelle masse de dihydrogène a été utilisée ?
12 g
2. Le balancement d’équations chimiques
1. Qu’est-ce que le balancement d’équations
chimiques ?
Le balancement d’équations
chimiques consiste à ajouter des coefficients
devant la formule chimique des réactifs et des
produits afin de respecter la loi de la conservation
de la masse.
2. Qu’est-ce qu’une équation squelette ?
Une équation squelette est une équation chimique
qui présente les réactifs et les produits d’une
transformation sans tenir compte de la loi de la
conservation de la masse.
3. Qu’est-ce qu’un coefficient ?
Un coefficient
est un nombre placé devant chaque formule
chimique d’élément ou de composé des réactifs
ou des produits.
4. Balancez les équations chimiques suivantes :
a. NO2 → N2O4
2NO2 → N2O4
b. CO O2 → CO2
2CO + O2 → 2CO2
c. FeCl3 NaOH → Fe(OH)3 NaCl
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
d.
Fe2O3 CO→ Fe CO2
Fe2O3 + 3CO → 2Fe + 3CO2
3. La stœchiométrie
1. Que sont les rapports molaires ?
Les rapports molaires sont les proportions entre
les moles des réactifs et des produits dans une
équation chimique balancée.
2.
Quelle est l’utilité des calculs stœchiométriques ?
Les calculs stœchiométriques permettent
de déterminer la quantité nécessaire
d’un réactif dans une réaction ou de prévoir
la quantité de produit obtenu à la suite d’une
réaction.
3. Le coussin gonflable d’une automobile se remplit
de diazote (N2) produit lors de la réaction de
décomposition suivante :
2 NaN3 (s) → 3 N2 (g) + 2 Na (s)
Dans une petite voiture, il faut normalement
2 mol de N2 (g) pour gonfler le coussin du côté du
conducteur.
Quel est le nombre de moles de
NaN3 (s) nécessaires pour produire le diazote ?
1.33 mole
4. L’ammoniaque gazeuse NH3 (g) réagit avec du
dioxygène O2 pour former de l’eau H2O et de
l’oxyde d’azote NO selon l’équation suivante :
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g)
a) Quelle masse de dioxygène réagira avec
34.0 g d’ammoniaque ?
79.8 g
b) Combien de moles de NO (g) seront formées
si 320 g de dioxygène réagissent avec suffisamment
d’ammoniaque ?
8 moles
4. La nature de la liaison
1.
Quelle est la différence entre la liaison
ionique et la liaison covalente à l’égard des
électrons de valence ?
La liaison ionique se
produit lorsqu’il y a un transfert d’électrons d’un
atome à un autre, alors que la liaison covalente
se produit lorsqu’il y a partage d’électrons entre
deux atomes.
2. Qu’est-ce que l’électronégativité ?
L’électronégativité est la capacité d’un
élément à attirer les électrons lors d’une liaison
chimique.
3.
Qu’est-ce qu’un composé ionique ?
Un composé ionique est le produit formé par
une liaison ionique.
4.
De façon générale, entre quelles catégories
d’éléments une liaison ionique se produit-elle ?
Entre un métal et un non-métal.
5. Parmi les composés suivants, quels sont
ceux qui contiennent une ou plusieurs
liaisons ioniques ?
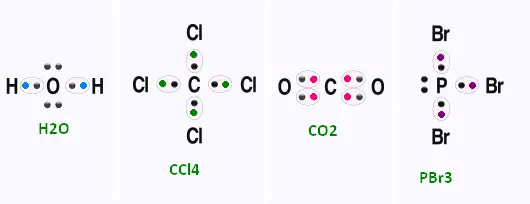
CO2, H2O, CaCl2, CCl4, LiF, CaCO3, PBr3, FeSO4
CaCl2, LiF, CaCO3, FeSO4
6. Parmi les composés de la liste précédente,
illustrez ceux qui contiennent une ou
plusieurs liaisons covalentes à l’aide de la
notation de Lewis.
5. Les règles de nomenclature et d’écriture
1. Quelle est l’utilité des règles de
nomenclature?
Les règles de nomenclature
permettent de nommer les composés chimiques
et de les distinguer entre eux.
2. En chimie, qu’est-ce qu’une règle
d’écriture ?
Les règles d’écriture permettent
d’écrire les formules des composés chimiques
selon des conventions établies.
12. Trouvez le nom ou la formule des composés
suivants.
a. CsCl Chlorure de césium
b. AgF Fluorure d’argent
c. Tétrabromure de carbone CBr4
d. Ca(NO3)2 Dinitrate de calcium
e. Hexachlorure de soufre SCl6
f. Le composé formé de strontium et de chlore SrCl2,
dichlorure de strontium
g. Le composé formé de chlore et d’aluminium
AlCl3, trichlorure d’aluminium
6. La neutralisation acidobasique
1. Qu’est-ce que la neutralisation acidobasique ?
La neutralisation acidobasique est
la transformation chimique dans laquelle
un acide et une base réagissent ensemble pour
former un sel et de l’eau.
2. Pourquoi considère-t-on que la neutralisation
acidobasique est une réaction réciproque ?
Parce que l’acide agit sur la base,
et la base, sur l’acide.
3. Après avoir versé une solution d’acide chlorhydrique
(HCl) dans un bécher, on plonge l’extrémité d’un pH-mètre
dans la solution.
Le pH-mètre indique 1.9.
a. Que se passera-t-il si on ajoute une solution
d’hydroxyde de potassium (KOH) goutte à
goutte dans l’acide ?
Les ions OH– de chaque
goutte réagiront avec une quantité égale d’ions
H+ pour former de l’eau (H2O) :
c’est une réaction
de neutralisation acidobasique. Cette réaction
ne sera complète que lorsqu’on aura versé une
quantité de KOH suffisante pour neutraliser la
quantité de HCL initialement présente. La quantité
d’ions H+ diminuera progressivement. Le pH
augmentera donc petit à petit à chaque goutte
de KOH ajoutée.
b. Déterminez l’équation chimique complète
de cette réaction.
HCl (aq) + KOH (aq) → KCl (aq)+ H2O (l)
c. À partir du moment où la quantité d’ions
OH- sera supérieure à la quantité d’ions
H, qu’adviendra-t-il du pH ?
Il sera supérieur à 7.
7. La synthèse, la décomposition
et la
précipitation
1. Qu’est-ce que la synthèse ?
La synthèse est une transformation chimique
dans laquelle des éléments ou composés simples
réagissent et forment un composé plus
complexe.
2. Qu’est-ce que la décomposition ?
La décomposition est une transformation
chimique dans laquelle un composé se sépare
en éléments ou en composés plus simples.
3. Qu’est-ce que la précipitation ?
La précipitation est la formation d’un solide peu
soluble ou insoluble lors du mélange de deux
électrolytes.
4. Déterminez à quel type de réaction (synthèse,
décomposition ou précipitation) correspond
chacune des transformations chimiques
suivantes.
a) CaCl2 (s) → Ca (s) + Cl2 (g)
Décomposition.
b) CaBr2 (aq) + Pb(NO3)2 (aq) → PbBr2 (s) + Ca(NO3)2 (aq)
Précipitation.
c) 2 Li (s) Cl2 (g) → 2 LiCl (s)
Synthèse.
8. Les réactions endothermiques
et
exothermiques
1. Qu’est-ce qui distingue une réaction
endothermique d’une réaction exothermique
?
Une réaction endothermique est
une transformation chimique qui absorbe de
l’énergie, alors qu’une réaction exothermique
est une transformation chimique qui dégage de
l’énergie.
2. Donnez un exemple de réaction endothermique
présente dans l’environnement.
La photosynthèse.
3. Donnez un exemple de réaction exothermique
présente dans l’environnement.
La
combustion du bois lors d’un feu de forêt,
la respiration.
4. Déterminez si les transformations chimiques suivantes
sont endothermiques ou exothermiques:
a. Lors de la décomposition de l’eau par
électrolyse, dès que le courant électrique
est coupé, la réaction de décomposition
s’arrête.
Endothermique.
b. Quand le dihydrogène est soumis au test
de la flamme, une détonation se fait
entendre.
Exothermique.
c) 2 H2 (g) + C (s) → CH4 (g) + 75 kJ
Exothermique.
5.
a. Calculez la quantité d’énergie en jeu si
768 g de H2I2 sont formés lors de la réaction
suivante :
H2 (g) + I2 (g) + 173 kJ → H2I2 (g)
519 kJ
b. Indiquez si la chaleur est absorbée ou
dégagée (réaction endothermique ou
exothermique).
La chaleur est absorbée
(endothermique).
9.L’oxydation et la combustion
1. Qu’est-ce que l’oxydation ?
L’oxydation
est une transformation chimique dans
laquelle le dioxygène ou une substance
ayant des propriétés semblables se combine
avec un réactif pour former un oxyde.
2. Donnez un exemple d’oxydation.
la combustion, la respiration
cellulaire, la formation de la rouille, la
corrosion.
3. Déterminez l’équation chimique de la
réaction d’oxydation du cuivre.
2 Cu (s) + O2 (g) → 2 CuO (s)
3. Quelles sont les trois composantes du « triangle
de feu » qui permettent la combustion ?
Le combustible, le comburant et le point d’ignition.
4. Définissez les trois catégories de réactions
de combustion et donnez un exemple pour
chacune d’elles.
a. Les combustions lentes ne forment pas de flamme,
elles se produisent à température ambiante et la
chaleur qu’elles dégagent se dissipe rapidement. Par
exemple : la respiration cellulaire, la formation de la
rouille.
b. Les combustions vives dégagent rapidement beaucoup
d’énergie sous forme de chaleur et de lumière
(souvent une flamme), l’énergie qu’elles libèrent
entretient la réaction, qui se produit à haute température.
Par exemple : la combustion du bois, de
l’essence (dans les moteurs à explosion).
c. Les combustions spontanées sont des combustions
vives qui s’amorcent sans apport d’énergie
externe. Par exemple : certains gaz très concentrés,
le foin qui fermente, les mélanges d’air et de poussière
dans les silos à grain vides.
10. La photosynthèse et la respiration
1. Qu’est-ce que la photosynthèse ?
La photosynthèse est la transformation
chimique par laquelle des organismes vivants
transforment l’énergie rayonnante du Soleil en
énergie chimique. C’est une réaction de synthèse
: les réactifs sont le dioxyde de carbone et
l’eau, les produits sont le glucose et le dioxygène.
2. Pourquoi la photosynthèse est-elle à la
base de la majorité des écosystèmes ?
Parce qu’elle permet aux cellules végétales de fabriquer
leur propre nourriture, le glucose, qui sert
ensuite de source d’énergie et de nutriment pour
produire d’autres molécules nécessaires à la vie.
3. Quelle substance capte le rayonnement
solaire lors de la photosynthèse ?
La chlorophylle.
4. Qu’est-ce que la respiration ?
La respiration est
la transformation chimique par laquelle l’énergie
contenue dans les sucres est libérée pour effectuer
un travail sur les cellules vivantes. C’est une combustion
lente du glucose : le comburant est le
dioxygène, les produits de la réaction sont le dioxyde
de carbone et l’eau.
5. Expliquez pourquoi la respiration et la photosynthèse
sont des réactions inverses.
La respiration
et la photosynthèse sont des réactions inverses
parce que les produits de l’une sont les réactifs de
l’autre, et vice versa.
|