Chimie 2
Rapport de laboratoire
Calorimétrie
Transfert d'énergie thermique
Transfert de chaleur
Calorimétrie
RAPPORT DE LABORATOIRE
Laboratoire # 1
Présenté à
Madame ou Monsieur .... ....
Par
Nom 1 Prénom 1
et
Nom 2 Prénom 2
Classe ....
École ....
Janvier 2015
1.But:
Vérifier la loi de la conservation de l’énergie pour un système isolé.
2. Hypothèse et méthode :
Quand deux objets, thermiquement isolés de l'extérieur, sont en
contact et à températures différentes, ils vont échanger de l'énergie thermique.
Ces échanges obéissent au principe de conservation de l'énergie.
Énonncé du principe de conservation de l'énergie:
Dans un système isolé, l'énergie totale se conserve.
Ce principe reste valable dans le cas particulier où le système est composé
de deux corps et que l'énergie est sous forme thermique.
La quantité d'énergie Qr reçue par un corps froid est égale à la
quantité d'énergie Qc cédée par le corps chaud.
Ce qui symboliquement s'écrit :
Qr = - Qc ou Qr + Qc = 0
. Si la substance dégage de la chaleur, la valeur de Qc est négative.
. Si la substance absorbe de la chaleur, la valeur de Qr est positive
Pour démontrer que la quantité de chaleur perdue par le corps qui se refroidit est égale à la quantité de chaleur gagnée par le corps qui se réchauffe, nous allons mesurer le transfert de chaleur entre un cylindre d'acier et de l'eau distillée à l'intérieur d'un calorimètre qui assure l'isolation du système.
3. Principes théoriques
• Pour calculer la chaleur dégagée ou absorbée par une substance,
nous utilisons la formule suivante:
Q = m c ΔT
m = masse de la substance
c = chaleur massique ou capacité thermique massique
Δt = T(finale) - T(initiale)
Q est la quantité de chaleur ou l'énergie thermique échangée. Elle
s'exprime en Joules (J).
• On note bien qu'aux conditions normales de pression (pression atmosphérique),
la température d'ébullition de l'eau est égale à 100 oC.
4. Matériel et schéma de l'expérience:
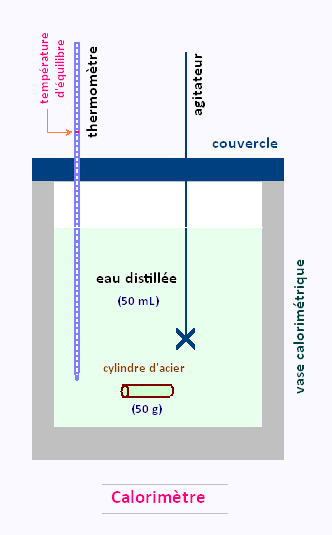
• Calorimètre
• Thermomètre
• Cylindre gradué de 100 mL
• Pinces
• Balance
• Plaque chauffante
• Cylindre d'acier
• Bêcher de 250 mL
• Eau distillée
Bien faire attention de ne pas toucher la plaque chaffante à cause de
sa température élevée.
4. Manipulations:
• Verser, pour mesurer, 50 ml d'eau distillée dans un cylindre gradué 100 mL
• Verser les 50 ml d'eau du cylindre gradué dans le calorimètre
• Mesurer la température de l'eau versée dans le calorimètre avec
le thermomètre. Noter la température.
• Verser 200 ml d'eau dans le bêcher
• Allumer la plaque chauffante à HIGH.
• Déposer le bêcher sur la plaque chauffante et attendre que l'eau bouille.
• En ce temps, peser le cylindre d'acier avec la balance. Noter sa masse.
• Déposer le cylindre d'acier dans l'eau bouillante (100oC) du bêcher
qui se trouve sur la plaque chauffante.
• Garder le cylindre d'acier 5 minutes dans l'eau bouillante.
• Sortir le cylindre d'acier avec la pince.
• Déposer le cylindre dans le calorimètre.
• Mesurer la température de nouveau. Noter la température.
5. Mesures et calculs relatis
1. Les températures:
Température intiale de l'eau distillée = 21.5 oC
Température finale de l'eau distillée à l'équilibre =
30oC
ΔT = 30 - 21.5 = 8.5oC
Température intiale du cylindre d'acier = 100oC
Température finale du cylindre d'acier à l'équilibre = 30oC
ΔT = 30 - 100 = - 70oC
2. Les masses:
Masse mesurée du cylindre d'acier = 50 g
La masse volumique de l'eau est égale à 1 kg/l = 1000 g/ 1000 mL = 1 g/mL.
Ainsi pour un volume de 50 mL, on a:
Masse calculée de 50 mL d'eau distillée = 50 g
3. Les quantités de chaleur:
Q(l'eau distillée) = 50 x 4.18 x 8.5 = 1776.5 J
Q(cylindre d'acier) = 50 x 0.51 x (- 70) = - 1785 J
Nous avons:
Q(cédée) + Q(reçue) = 0
6. Résultats
| substance | cylindre d'acier | eau distillée |
| masse (g) | 50 | 50 |
| chaleur massique (J/g.oC) | 0.51 | 4.18 |
| températue initiale (oC) | 100 | 21.5 |
| températue finale (oC) | 30 | 30 |
| différence de températue (oC) | - 70 | 8.5 |
| quantité de chaleur (J) | - 1785 | 1776.5 |
| transfert de chaleur (kJ) | cédée: 1.8 | reçue: 1.8 |
7. Conclusion
Les quantités de chaleur ou les énergies transférées dépendent des masses et des températures
mesurées ou calculées. Les valeurs mesurées sont assujetties à des erreurs.
De ce fait, les deux valeurs des quantités de chaleur calculées comportent des
incertitudes de mesure. Les résultats obtenus pour ces deux valeurs sont en bon accord.
Ainsi, dans le calorimètre, la quantité de chaleur perdue par le cylindre d'acier est la même que la quantité de chaleur gagnée par l'eau utilisée pour le refroidir.
Nous avons vérifié le principe de la conservation de l’énergie pour un système isolé.
|