Chimie 2
Énergie et réactions chimiques
La fonction enthalpie
L'enthalpie d'une réaction chimique
1. Calcul de l'enthalpie de liaison standard de l'eau
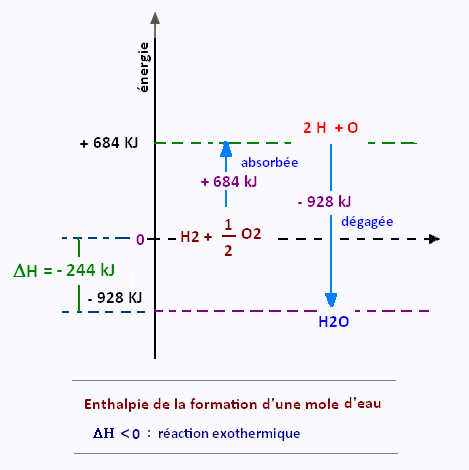
On veut détermine la chaleur de réaction de la synthèse de l’eau:
Réaction :
H2(g) + (1/2) O2(g) → H2O(g)
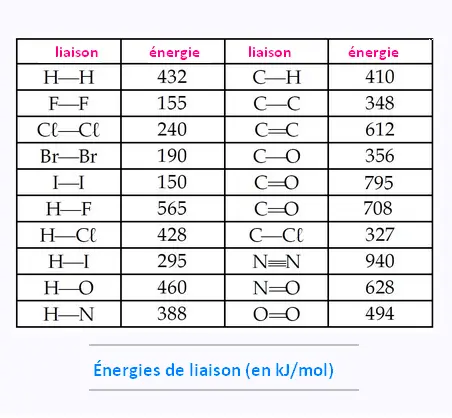
À partir des tableaux d’enthalpie moyenne en kJ/mol
de liens brisés, établissons le bilan énergétique de cette réaction:
Bris des liaisons:
Les liaisons à briser sont: H-H et O = O :
E(H-H) = + 435 kJ
(1/2) E(O = O) = (1/2) 498 = 249 kJ
Énergie totale absorbée: + 684 kJ.
Formation des liaisons:
2 x (H – O): 2(- 464) = - 928 kJ
Énergie totale dégagée: - 928 kJ
Énergie absorbée + Énergie dégagée = Énergie de la réaction
(+ 684 kJ) (- 928 kJ) = - 244 kJ/mol (réaction exothermique)
Donc, cette réaction dégage 244 kilojoules par mole d’eau formée.
Cette réaction est exothermique: ΔH < 0.
Une réaction exothermique est celle qui dégage de la chaleur.
L'enthalpie des produits est plus petite que l'enthalpie des réactifs.
Pour une réaction réaction endothermique, qui absorbe de la chaleur,
la ΔH est positif car l'enthalpie des produits est plus grande que l'enthalpie des réactifs.
Dans cette réaction de la formation de l'eau, le produit, soit le H2O, dégage plus d’énergie qu’il en absorbe.
2. Calcul de l'enthalpie de liaison standard
de la synthèse de l'ammoniac
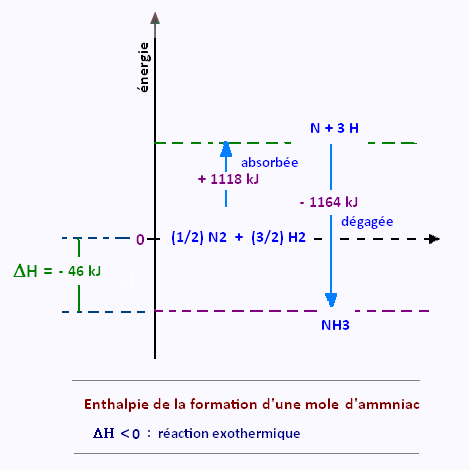
On veut détermine l'enthalpie de réaction de la synthèse de l'ammoniac:
Réaction :
(1/2) N2 + (3/2) H2 → NH3
À partir des tableaux d’enthalpie moyenne en kJ/mol
de liens brisés, établissons le bilan énergétique de cette réaction:
Bris des liaisons:
Les liaisons à briser sont: H-H et N ≡ N:
(3/2) E(H-H) = (3/2) (+ 432 kJ) = 648 kJ
(1/2) E(N ≡ N) = (1/2) (+ 940 kJ) = 470 kJ
Énergie totale absorbée: + 1118 kJ.
Formation des liaisons:
3(N - H): 3( - 388) = - 1164 kJ
Énergie totale dégagée: - 1164 kJ
Énergie absorbée + Énergie dégagée = Énergie de la réaction
(+ 1118 kJ) (- 1164 kJ) = - 46 kJ/mol (réaction exothermique)
Donc, cette réaction dégage 46 kilojoules par mole d’ammoniac formée.
Cette réaction est exothermique: ΔH < 0.
L'enthalpie des produits est plus petite que l'enthalpie des réactifs.
Dans cette réaction de la formation de l'ammoniac, le produit, soit le NH3, dégage plus d’énergie qu’il en absorbe.
|