Chimie Organique
Molecules Organiques
et Médicinales
Des planches
BD
Les Aromatiques
© The scientific sentence. 2010
| |
|
Chimie 2:
Chimie organique
Les orbiales atomiques
1. Définitions
Dans un atome, l'électron n'est pas localisé. Les régions de l'espace autour
du noyau de l'atome, où cet électron a une forte probabilité de se trouver
s'appelle l'orbitale atomique.
Une orbitale atomique est une zone de l'espace où la probabilité de
trouver un électron autour du noyau est, par convention, égale ou supérieure à
95%.
Les orbitales atomiques sont caractérisées par trois nombres quantiques: le nombre quantique principal n qui définit la taille de l'orbitale, le nombre quantique azimutal l qui précise la forme de l'orbitale, et le nombre quantique magnétique ml qui spécifie son orientation dans un champ magnétique.
Chaque valeur du nombre quantique azimutal l définit une sous-couche électronique. Des électrons possédant à la fois une même valeur de n et une même valeur de l appartiennent à la même sous-couche. Ces sous-couches sont appelées orbitales et sont également désignées par des lettres :
• l = 0 : sous-couche s
• l = 1 : sous-couche p
• l = 2 : sous-couche d
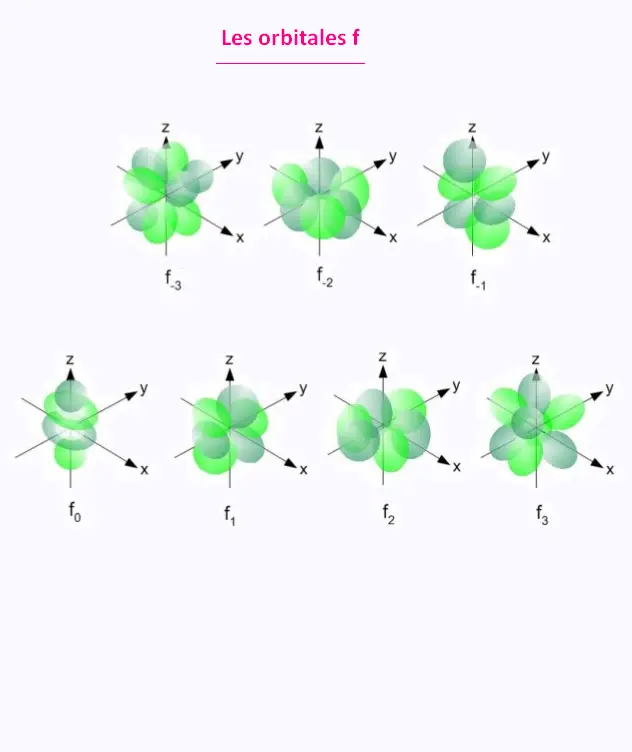
• l = 3 : sous-couche f
les orbitales atomiques pour un même n et un même l ont la même
taille, la même forme, mias des orientations différentes:
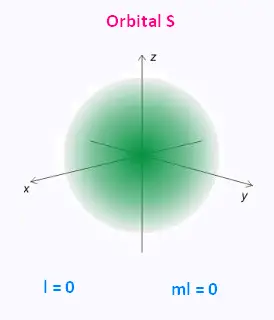
• l = 0 : l'orbitale s est une sphère et est centrée sur le noyau.
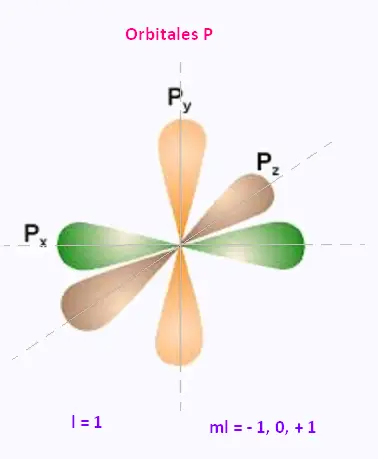
• l = 1 : l'orbitale p est une paire de deux lobes centrés sur un axe commun.
• l = 2 : l'orbitale d : sphère et lobes .
• l = 3 : l'orbitale f.
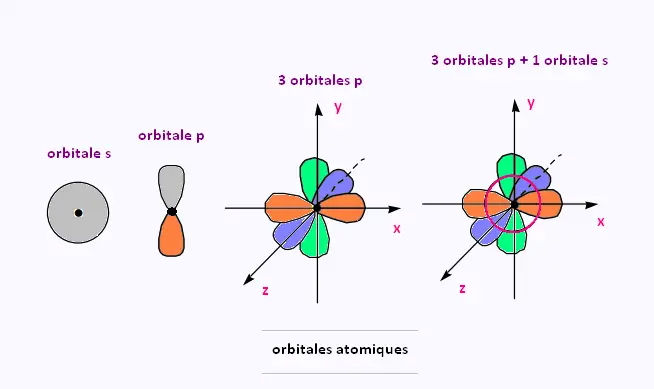
2. Orbilates s
3. Orbilates p
4. Orbilates d
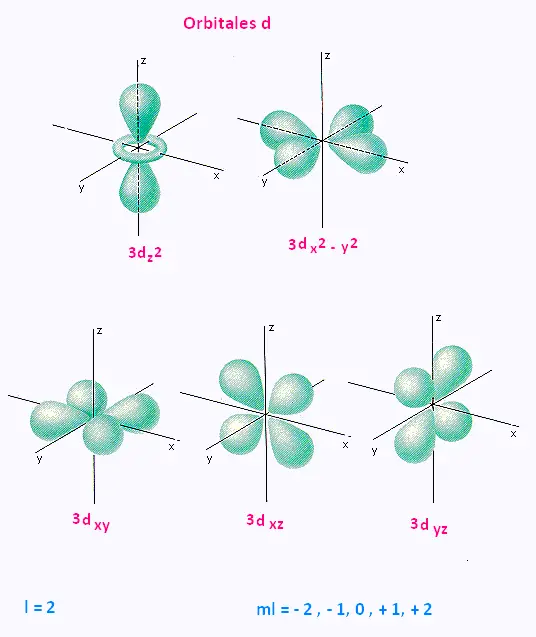
Trois orbitales d comportent quatre lobes dans les plans bissecteurs des quadrants : dxy, dxz, dyz.
Les deux autres orbitales d sont centrées sur les axes : dx2-y2 suivant les axes x et y,
dz2 a deux lobes centrés sur l'axe z et possède un petit volume torique dans le plan xOy.
5. Orbilates f
|
|