Maths 436
Sciences
Révisions
Mathématiques
Corrigés
Sciences
© The scientific sentence. 2010
|
Chimie:
Les constituants de la matière
Je confirme mes acquis
Les constiuants de la matière
1.1. Le modèle atomique de Rutherford-Bohr
1. Quelle particule élémentaire Rutherford a-t-il découvert?
Le proton
2. Où cette particule se trouve-t-elle dans l’atome ?
Dans le noyau
3. Quelle est sa charge ?
Charge du proton = + 1.6 x 10 -19 C
4. Quelle est la contribution de Bohr au modèle atomique de Rutherford ?
Sur des couches électroniques, les électrons gravitent autour du noyau
5. Quels sont les couches électroniques d’un atome?
S (n = 1), P(n = 2), D(n = 3) , F(n = 4)
1.2. Le modèle atomique simplifié et le neutron
1. Quelle découverte faite par Chadwick qui est à l’origine d’une modification du modèle atomique de
Rutherford-Bohr ?
Le neutron
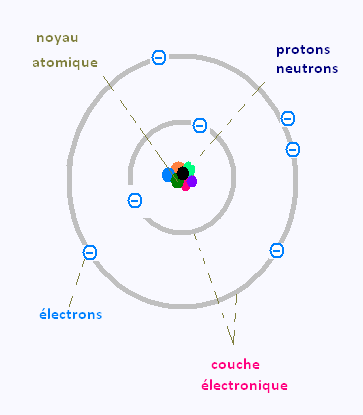
2. Réalisez un dessin qui représente le modèle atomique simplifié, en identifiant toutes ses parties.
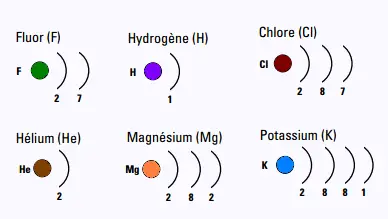
3. Représentez de façon schématisée la configuration électronique des éléments:
Potassium (K),
Hydrogène (H),
Fluor (F) ,
Magnésium (Mg),
Chlore (Cl) ,
Hélium (He)
4. Que sont les électrons de valence ?
Ce sont les électrons de la couche externe
1.3. La notation de Lewis
Représenter selon le modèle de Lewis les atomes:
Hydrogène,
Sodium ,
Hélium ,
Bore ,
Oxygène

1.4. Les familles et les périodes du tableau
périodique
1. Nommez les trois grandes catégories d’éléments du tableau périodique.
Les métaux, les non-métaux, et les métalloïdes
2. Quelle est la relation entre le numéro de la famille
et la configuration électronique des éléments qui en font partie ?
Le chiffre romain qui représente le numéro de la famille
indique le nombre d’électrons de valence
des éléments de cette famille
1.5 La masse atomique relative et les isotopes
1. Qu’est-ce que la masse atomique relative ?
C'est la masse par rapport à celle d'un atome étalon,
qui est le carbone (12). Elle s'exprime en unité de masse atomique
(u).
2. Quelle est la masse atomique relative de l’oxygène?
Elle est égale à 16 u
3. Qu’est-ce que l'unité de masse atomique ?
L'unité de masse atomique (u) est égale au 1/12
de la masse de l'atome de Carbone (12). Elle vaut
1.66 x 10 - 27 kg
4. Qu’est-ce que la masse atomique moyenne
La masse atomique moyenne est égale à
la moyenne, pondérée par les abondances naturelles, des masses
relatives des isotopes de l'élément
5. Qu’est-ce qu’un isotope ?
C'est l'atome d'un même élément dont
le noyau contient un nombre différent de neutrons.
6. Qu’est-ce qu'un numéro atomique ?
Le numéro atomique est le nombre entier qui correspond
au nombre de protons de l'élément
7. Qu’est-ce qu'un nombre de masse ?
Le nombre de masse est un nombre entier
qui correspond à la somme des nombres de
protons et des neutrons dans le noyau
8. Combien de neutrons un atome de fluor 19 contient-il ?
10 neutrons
9. Quelle indication le numéro de la période
fournit-il ?
Le numéro de la période indique le
nombre de couches électroniques contenues dans
un élément faisant partie de cette période
10. Pourquoi la masse atomique inscrite
dans le tableau périodique est souvent un
nombre décimal.
Parce qu’il s’agit de la masse
atomique moyenne, qui tient compte de la masse
relative de chaque isotope d’un élément et de son
abondance dans la nature.
1.6. La périodicité des propriétés
À l’aide du tableau périodique, répondre aux
questions suivantes.
1. Pourquoi le Chlore (Cl) possède-t-il une masse atomique
plus grande que le Magnésium (Mg)?
Parce que le chlore est situé à droite du
magnésium dans la troisième période. Le chlore a
un numéro atomique et un nombre de nucléons
plus élevés que ceux du magnésium.
2. Pourquoi la taille d’un atome de baryum (Ba) est-elle
supérieure à celle d’un atome de magnésium (Mg)?
Le rayon atomique du
baryum est plus grand que celui du magnésium,
car le baryum est situé au-dessous du magnésium
dans la seconde famille. Le baryum comprend un
plus grand nombre de couches électroniques
3. Pourquoi, dans une période, l’électronégativité des éléments a-t-elle tendance
à s’accroître de la gauche
vers la droite du tableau ?
Parce que les non-métaux cherchent à
gagner des électrons et les attirent donc avec
une force plus grande
4. Classez les éléments de chacun des ensembles suivants par
ordre décroissant d’énergie d’ionisation:
a. Mg, Sn, Cl
b. Al, B, In
c. Ne, Ar, Xe Ne, Ar, Xe
a.
Cl, Sn, Mg :
le nombre de protons
décroît de Cl à Mg. Il devient donc plus facile
d’arracher des électrons.
b.
B, Al, In : le nombre de couches électroniques
croît de B à In, donc il devient plus
facile d’arracher des électrons.
c.
Ne, Ar, Xe Ne, Ar, Xe : le nombre de
couches électroniques croît de Ne à Xe, donc il
devient plus facile d’arracher des électrons.
La notion de mole et le nombre d’Avogadro
1. Qu’est-ce qu’une mole ?
Une mole est une
quantité précise de particules qui correspond au
nombre d’Avogadro.
2. À quelle quantité correspond le nombre
d'Avogadro ?
Le nombre d’Avogadro
correspond au nombre d’atomes présents dans
exactement 12 g de carbone 12.
3. Combien y a-t-il d’atomes ou de molécules
dans chacune des quantités suivantes ?
a. 3 moles d'atomes de Fe (s)
1.81 x 1024 atomes de Fe
b. 0.5 mole de molécules d’eau
3.01 x 1023 molécules d’eau
c. 100 moles de N2 (g)
6.02 x 1025 molécules de N2
d. 2.7 moles de NaCl (s)
1.63 x 1024 molécules de NaCl
4. À combien de moles correspondent chacun des
nombres d’atomes ou de molécules suivants ?
a. 7.525 x 1024 atomes de Cu
12.5 mol
b. 2.408 x 1026 molécules de O2
400 mol
c. 4.816 x 1024 molécules de CH4
8 mol
d. 3.311 x 1024 molécules de He
5.5 mol
5. Combien y a-t-il de moles dans chacune des
quantités suivantes ?
a. 48 g de K
1.23 mol
b. 27 g de N2
0.96 mol
c. 345 g de CO2
7.84 mol
d. 0.27 g de NaNO3
3.18 x 10- 3 mol
e. 150 g de Ca(OH)2
2.02 mol
6. Quelle est la masse de chacun des échantillons
suivants ?
a. 1 mol de plomb (Pb)
207.21 g
b. 1 mol d’ozone (O3)
48 g
c. 15 mol d’eau (H2O)
270.3 g
d. 18 mol de MgCl2 (s)
1 713.78 g
e. 0.000 23 mol de Al2S3
0.03 g
7. Combien y a-t-il de moles dans chacun des
échantillons suivants ?
a. 500 g de sel de table (NaCl)
8.7 mol
b. 250 g de sel de voirie (CaCl2)
2.25 mol
c. 500 g de soude (NaOH)
12.5 mol
d. 200 g d'or (Au)
1.02 mol
e. 500 g de glucose (C6H12O6)
2.78 mol
8. Combien y a-t-il d'atomes dans 3 moles d’atomes de Fe (s)
9. À combien de moles correspond 2.408 x 1026 molécules de O2
10. Combien y a-t-il de moles dans 48 g de K, 345 g de CO2 et 150 g de Ca(OH)2
11. Quelle est la masse de 1 mol de plomb (Pb), 15 mol d’eau (H2O) et 0.000 23 mol de Al2S3
12. Combien y a-t-il de moles dans 250 g de sel de voirie (CaCl2) et 500 g de glucose (C6H12O6)
|
|