Physique
Chimie
TS
Chimie
Les acides et les bases
Applications
Mesure du pH
Équilibre chimique
Applications
Exercices résolus
Spectroscopie
RMN du Proton
Applications
Exercices résolus
Propagation
du signal
Mécanique
© The scientific sentence. 2010
|
Chimie 5:
Chimie des solutions
Approximation milieu acide
Domaines de prédominance
1. Approximation milieu acide
Dans le cas d'un milieu acide où les ions H3O+ prédominent
sur les ions HO-, on considère la limite suivante:
[H3O+]/[HO-] ≥ 10
Ke = [H3O+] [HO-] = 10-14
Donc:
[H3O+]2]/10-14 ≥ 10
[H3O+]2 ≥ 10-13
[H3O+] ≥ √(10-13)
D'où:
pH ≤ 6.5
Résumé:
Dans un milieu acide: H3O+ prédominent
sur les ions HO-. L'approximation [H3O+]/
[HO-] ≥ 10 conduit à pH ≤ 6.5
2. Approximation milieu acide
De l'équation acido-basique suivante:
HA + H2O  H3O+ + A-
,
H3O+ + A-
,
Nous avons:
Ka = [H3O+][A-]/[HA]
on tire:
pH = pKa + log (A-/[HA])
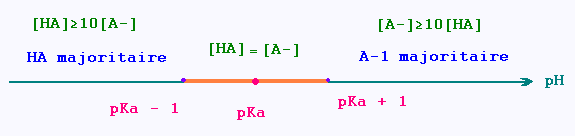
1. HA prédomine sur A-: [HA]/[A-] ≥ 10
C'est à dire que l'acide HA est peu dissocié
[HA]/[A-] ≥ 10
implique :
pH ≤ pKa - 1
2. A- sur HA prédomine :[A-]/[HA] ≥ 10
[A-]/[HA] ≥ 10
implique :
pH ≥ pKa + 1
3. [A-] = [HA]
[A-] = [HA]
implique :
pH = pKa
|
|