Physique
Chimie
TS
Chimie
Les acides et les bases
Applications
Mesure du pH
Équilibre chimique
Applications
Exercices résolus
Spectroscopie
RMN du Proton
Applications
Exercices résolus
Propagation
du signal
Mécanique
© The scientific sentence. 2010
|
Chimie 5:
Chimie des solutions
Forces des acides et des bases
Forces des acides et des bases
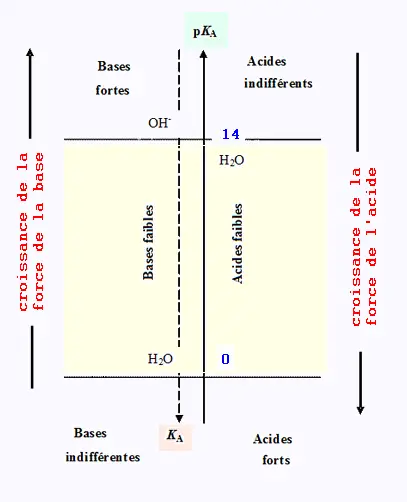
• Lorsqu'un acide est fort, sa réaction avec l'eau sera totale.
Par contre, un acide faible réagira partiellement avec l'eau.
• Lorsqu'une base est forte, sa réaction avec l'eau est totale.
Par contre, une base faible réagira partiellement avec l'eau.
• Un acide est d'autant plus fort que sa constante
d'acidité KA est plus grande donc son pKA plus petit.
• Un acide fort est un acide plus fort que H3O+.
Son pKa négatif.
• Un acide faible est un acide moins fort que H3O+.
Son pKa positif.
• Une base est donc d'autant plus forte que son
acide conjugué est plus faible.
• Une base est forte si elle est plus forte que OH- .
Son pKa est supérieur à 14.
• Une base est faible si elle est moins forte que OH-.
Son pKa inférieur à 14.
• Un acide plus fort que H3O+ est totalement dissocié dans l'eau.
L'acide le plus fort qui puisse exister est leH3O+.
• Une base plus forte que OH- est totalement dissociée
dans l'eau. La base la plus forte qui puisse exister
est le OH- .
• Une base qui ne réagit pas avec l'eau est dit base extrêmement
faible : on dit que c'est une base indifférente dans l'eau.
Exemple: L'ion chlorure Cl- est la base conjuguée de l'acide fort HCl.
• Un acide qui ne réagit pas avec l'eau est dit acide extrêmement
faible. on dit que c'est un acide indifférent.
Exemple: L'éthanol CH3CH2OH, l'acide conjugué de la base ion éthanolate
CH3CH2O-.
• L'acide conjugué d'une base forte est un acide indifférent.
• La base conjuguée d'un acide fort est une base indifférente .
• L'acide conjugué d'une base faible est un acide faible.
|
|