Physique
Chimie
TS
Chimie
Les acides et les bases
Applications
Mesure du pH
Équilibre chimique
Applications
Exercices résolus
Spectroscopie
RMN du Proton
Applications
Exercices résolus
Propagation
du signal
Mécanique
© The scientific sentence. 2010
|
Chimie 5:
Chimie des solutions
Calcul de pH
pH des polyacides et polybases
l’acide phosphorique
1. pH de l’acide phosphorique
Soit une solution d’acide phosphorique à
C = 0.5 mol.L-1.
Les trois acidités ont pour constante d’acidité :
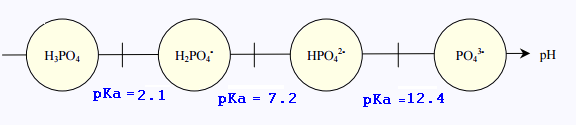
pKa1 = 2.1 ; pKa2 = 7.2 et pKa1 = 12.4.
Voici le diagramme de prédominance et les
et les espèces chimiques présentes:
L’acide le plus fort en solution, l’acide phosphorique,
réagit avec la base la plus forte présente, l’eau :
H3PO4 + H2O  H2PO4- + H3O+
H2PO4- + H3O+
La constante de réaction est : K = Ka1 = 10-2,1.
C’est une réaction déplacée dans le sens de la formation de
la forme acide.
On en déduit que la forme majoritaire sera H3PO4.
On calcule pKa - pC = 1.1 < 2. L’acide est effectivement
moyennement dissocié. Comme pKa - pC est compris entre
-1 et 2, on doit résoudre :
y2 + Ka1.y - C.Ka1 = 0
Pour établir cette relation , on part des concentrations
à l’état d’équilibre :
H3PO4 + H2O  H2PO4- + H3O+
H2PO4- + H3O+
| E.I. |
C | - |
0 | 0 |
| E.C. |
- y | - |
y | y |
| E.E. |
C - y | - |
y | y |
Par définition:
Ka = y x y /(C - y)
Ka = y2/(C - y)
Sachant que : Ka1 = [H2PO4-].[H3O+] / [H3PO4], on en déduit que
: Ka1 = y2 / (C - y), d’où l’équation du second degré.
y2 + Ka1.y - C.Ka1 = 0
y2 + 2.1 y - 0.5 x 2.1 = 0
y2 + 2.1 y - 1.05 = 0
y = 0.42
D'où pH = 0.38.
2. Calcul des concentrations
Voici les 3 réactons simultanées:
H3PO4 + H2O  H2PO4- + H3O+
H2PO4- + H3O+
H2PO4- + H2O  HPO42- + H3O+
HPO42- + H3O+
HPO42- + H2O  PO43- + H3O+
PO43- + H3O+
• Calcul des concentrations en M :
[H3PO4] = 0.5 - 0.42 = 0.08
[H2PO4-] = y = 0.42
[HPO42-] = Ka2 y/y = Ka2 = 6.2 x 10-8
[PO43-] = Ka3 [HPO42-]/y
= 1.54 x x 10-19
Pour calculer le pH de ces solutions, on ne considère que le premier équilibre de
dissociation, les étapes ultérieures sont beaucoup moins importantes et peuvent être
ignorées.
On utilise donc la formule donnée pour les monoacides faibles avec la première constante
d’équilibre Ka1.
|
|


 H2PO4- + H3O+
H2PO4- + H3O+