Physique
Chimie
TS
Chimie
Les acides et les bases
Applications
Mesure du pH
Équilibre chimique
Applications
Exercices résolus
Spectroscopie
RMN du Proton
Applications
Exercices résolus
Propagation
du signal
Mécanique
© The scientific sentence. 2010
|
Chimie 5:
Chimie des solutions
Titrage potentiométrique
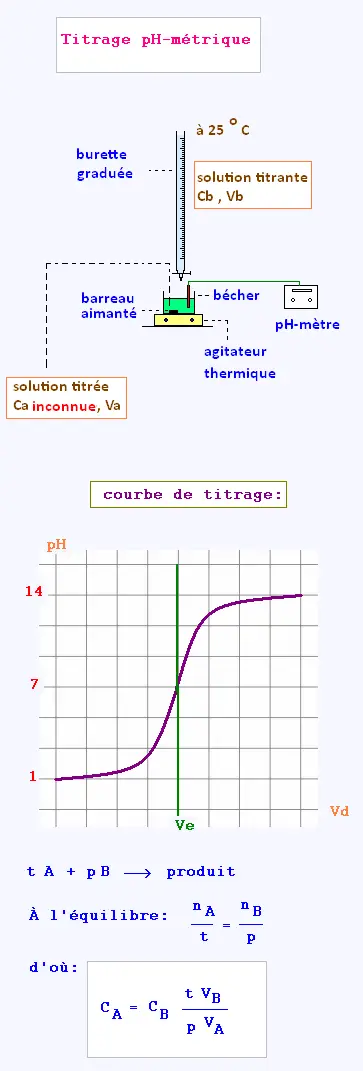
Titrage pH-métrique
1. Le titrage pH-métrique
Selon la méthode utilisée pour la détection
du point de neutralisation, il est possible de
réaliser un titrage par indicateurs colorés ,
un titrage conductimétrique ,
potentiométrique , ou spectrophotométrique , etc.
Le titrage pH-métrique est un titrage de type titrage
potentiométrique. C'est un titrage acide-base.
On traitera ici uniquement du titrage volumétrique
et pH_métrique.
2. Principe de la méthode
À l'aide d'une substance titrante de volme Vb et
de concentration Cb CONNUS, on dose la substance
dont on veut determiner le titre Ca, de volume Va, jusqu'à
l'épuisement du réactif titré. Mais avant, on doit
obtenir l' équivalence et détecter le point de
neutralisation .
3. Titrage pH-métrique
Ce type de titrage est réalisable uniquement avec des
acides et des bases, faibles ou forts, et au moyen
d'un pH-mètre.
En solution, les acides forts comme l'acide chlorhydrique
sont totalement dissociés et donnent des ions H3O+. De même,
les bases fortes se dissocient totalement pour libérer des ions
HO-.
Les ions H3O+ et HO-
réagissent de la façon suivante :
H3O+ + HO-
 2H2O
2H2O
À l'équivalence, tous les ions ont réagi,
la seule réaction qui se produit est celle de
l'autoprotolyse de l'eau , dite aussi
équation générale de neutralisation .
2H2O  H3O+ + HO-
H3O+ + HO-
Le pH est alors égal à 7.
L'équivalence est indiquée soit par un indicateur de pH, soit
indirectement par une courbe de titrage représentant le pH en
fonction du volume de base versé.
On doit pour cela relever les
valeurs du pH-mètre pour chaque millilitre de solution versée.
Quand le pH commence à augmenter de façon significative, verser
alors 0,2 ml de solution entre chaque mesure de pH.
Une fois que
le pH sera redevenu relativement stable, refaire une mesure de pH
tous les millilitres.
En traçant la courbe du pH en fonction
du volume de base versée, on obtient la courbe de neutralisaton .
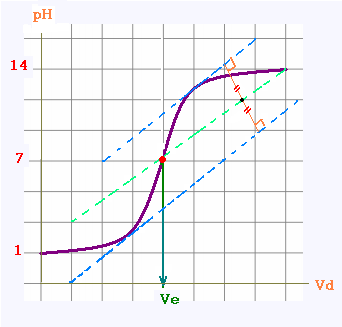
Pour retrouver le volume à l'équivalence,
on doit tracer deux tangentes de part et d'autre du point d'inflexion
(qui correspond à l'équivalence).
Les tangentes doivent être parallèles.
Tracer une perpendiculaire à ces deux droites, puis grâce à un compas,
tracer la médiatrice de la perpendiculaire.
La médiatrice doit être
parallèle aux tangentes. Le volume à l'équivalence est l'endroit
où la médiatrice et la courbe se rencontrent, pour un pH de 7.
On rappelle qu'en géométrie plane, la médiatrice d'un segment
est l'ensemble des points équidistants des deux extrémités
du segment. Cet ensemble est la droite passant par
le milieu du segment et qui est perpendiculaire au segment.
Le mot médiatrice vient du latin media, être au milieu de.
4. Titrage pH-métrique: Exemple
Titrage de HCl 0.1 M par NaOH 0.1 M
|
|