Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 :
Atome de Bohr
Règle de Klechkowski
Règle de Hund
Principe d'exclusion de Pauli
La règle de Hund, et la règle de Klechkowski, ainsi que le principe d'exclusion de Pauli,
constituent des outils de base permettant de prévoir le remplissage des orbitales atomiques dans
le modèle de Bohr.
1. Règle de Klechkowski
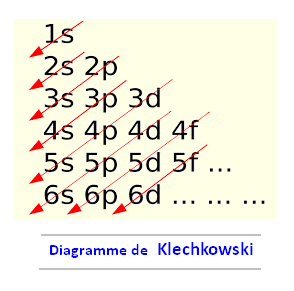
La règle de Klechkowski, également appelée règle de Madelung , est une méthode
empirique qui décrit l'ordre de remplissage des électrons dans les sous-couches d'un atome.
La règle de Klechkowski ne permet pas d’obtenir à coup sur la configuration
électronique réelle des atomes. A partir de n = 3 de nombreuses exceptions à cette
règle apparaissent.
Cette règle porte le nom du chimiste russe Vsevolod Kletchkovski,
(1900 - 1972). Kletchkovski était un agro-chimiste, principalement connu pour ses travaux
sur les radioisotopes et sur leur utilisation en agriculture.
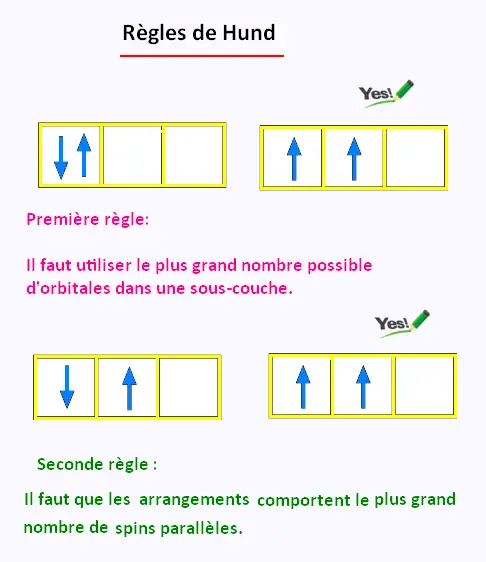
2. Règle de Hund
La règle de Hund détermine le remplissage le plus stable des électrons
sur les différentes orbitales électroniques des couches.
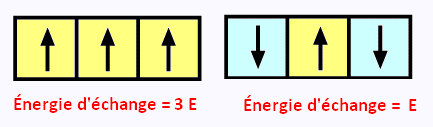
La répulsion électronique, c'est à dire entre deux électrons est associée une
énergie spécifique dite energie d'échange. Elle contribue
à l'énergie totale du système de deux électrons.
Cette énergie d'échange contribue à stabiliser les configurations
des électrons de même spin.
Considérons 3 électrons répartis sur les trois orbitales 2p. Si on admet que l'énergie
d'échange entre deux électrons de même spin portés par ces deux orbitales 2p est négative et vaut E
, on peut alors comparer la stabilisation énergétique des différents arrangements :
Voici les deux règles de Hund:
3. Principe d'exclusion de Pauli
L'état quantique d'une particule est défini par des « nombres quantiques ».
Le principe d'exclusion interdit à tout fermion
d'avoir exactement les mêmes nombres quantiques qu'un autre fermion du système.
Un fermion est une particule de spin demi-entier,
c'est-à-dire 1/2, 3/2, 5/2, ...). Un électron est un fermion de spin 1/2.
Le principe de Pauli s'énonce aussi: Si deux électrons occupent une
même orbitale, ils doivent tourner dans des directions opposées .
4. Orbitales électroniques
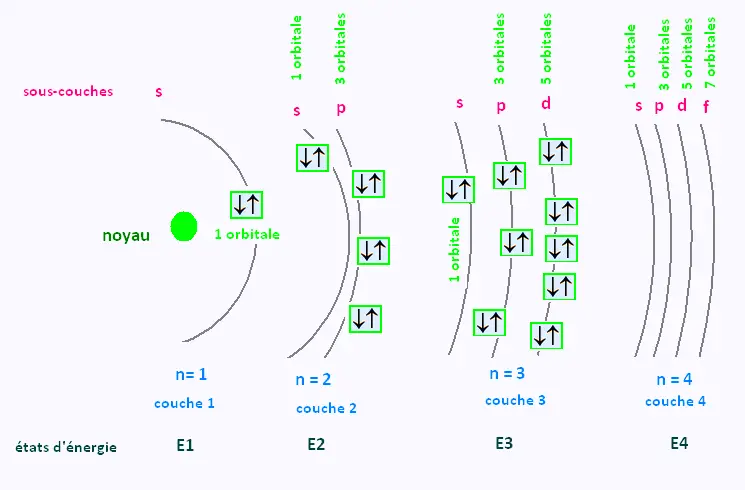
|
|