Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Physique 23 : Thermodynamique
Échanges d'énergie et changements d'état
Energie thermique, température et
changement d'état
Interprétation microscopique des
échanges d'énergie
1. Échanges d'énergie thermique
L' énergie thermique échangée par un corps est notée avec la lettre
Q et exprimée en Joules ou en kilojoules.
L'orsqu'un corps reçoit de l'énergie thermique celle-ci est notée positive
alors que s'il en cède elle est notée négative.
Par ailleurs, étant donnée que l'énergie se conserve, si un corps ( A ) reçoit une énergie
Q1 de la part d'un corps ( B ) qui échange une énergie Q2 alors Q1 = - Q2: les énergies
échangées par les deux corps ont la même valeur absolue mais des signes opposés.
2. Variation de température lors
d'un échange d'énergie
La variation de température d'un corps de masse m qui échange de l'énergie
thermique peut être exprimé avec la relation suivante:
Q = m x Cm x (Tf - Ti)
Où:
• Q est l'énergie thermique échangée exprimée en joule ( J )
• m est la masse du corps exprimée en kilogramme ( kg )
• Cm est une grandeur appelée capacité thermique massique dépendant
de la nature du corp. Cm est exprimée en Joule par degré celcius par kilogramme ( J.C-1.kg-1)
• Tf correspond à la température finale après l'échange d'énergie exprimée en degré celcius ( °C )
• Ti correspond à la température initiale avant l'échange d'énergie exprimée en degré celcius ( °C )
• Si le corps reçoit de l'énergie thermique alors Q > 0 dont Tf - Ti > 0 ce qui signifie que la température augmente alors que si un corps perd de l'énergie thermique Q < 0 donc Tf-Ti < 0 ce qui correspond à une baisse de température.
• Cette formule peut aussi être utilisée pour prévoir la température finale d'un corps lorsqu'on connait la valeur de l'énergie thermique échangée.
3. Changement d'état lors d'un échange d'énergie
Lorsqu'un corps pur change d'état sa température ne varie pas tant que
le changement n'est pas terminé.
La chaleur nécessaire à un changement d'état d'un corps de masse m dépends de cette
masse ainsi que d'une grandeur notée Lm et appelée energie massique de changement
d'état et elle peut être calculée grâce à la relation suivante:
Q = m x Lm
Où:
• Q est l'énergie thermique échangée pendant un changement d'état exprimée en joule ( J)
• m est la masse du corps exprimée en kilogramme ( kg )
• L est l'énergie massique de changement d'état exprimée en joule par kilogramme ( J.kg-1)
4. Le calorimètre
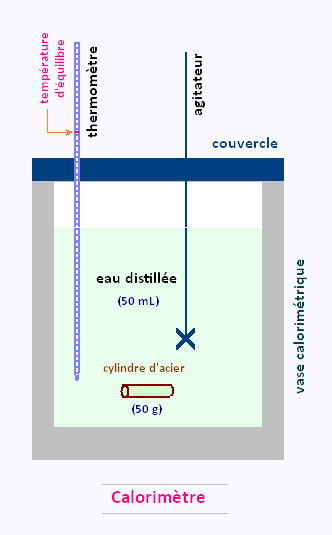
Lorsque l'on souhaite mesurer des échanges thermiques, les corps étudiés doivent être
isolés afin que l'énergie thermique ne soit pas communiquée à l'air, aux récipients et aux autres éléments.
On utilise alors un appareil appélé calorimètre qui permet non pas de supprimer totalement les échange d'énergie avec l'extérieur mais les limite et les rend évaluable ( un calorimétre possède une capacité thermique qui est connue ou qui peut être mesurée ).
|
|