Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 :
Atome de Bohr
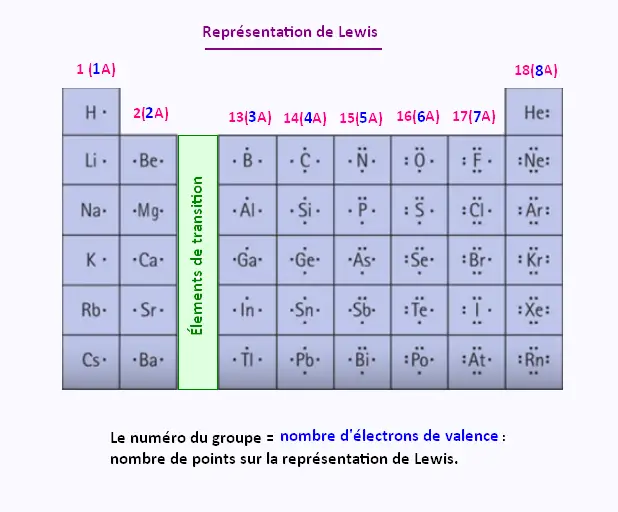
Représentation de Lewis
Electrons de valence et symboles de Lewis
Exceptions à al règle de l'octet
Règes de Lewis
1. Représentation de Lewis
Dans un atome, les électrons proches du noyau seront davantage stabilisés (par des effets électrostatiques) que les électrons éloignés du noyau. Il semble donc logique que les électrons éloignés soient responsables de la réactivité chimique des atomes. Cette différence majeure justifie que le chimiste fasse la distinction entre les électrons de cœur proches du noyau (relativement peu réactifs) et les électrons de valences périphériques de l'atome (responsables de la réactivité des éléments).
Prenons l'exemple de l'atome d'oxygène (Z = 16). Il y a 16 électrons à placer dans les différentes orbitales atomiques. La configuration électronique est donc 1s2 2s2 2p6 3s2 3p4. La dernière couche occupée est la couche de nombre quantique principal égal à 3. L'atome d'oxygène possède donc 6 électrons de valence et 10 électrons de cœur.
En pratique, les électrons de valence sont les électrons de la dernière couche électronique occupée de l'atome. Ce sont donc les électrons caractérisés par le nombre quantique principal n le plus élevé.
La notation à partir de la configuration électronique du gaz rare précédant l'atome met directement en évidence les électrons de valence. Pour l'oxygène : [Ne] 3s2 3p4.
Pour faciliter la représentation des liaisons chimiques, on utilisera donc des symboles reprenant uniquement les électrons de valence (symboles de Lewis). Ceux-ci sont identiques pour tous les éléments d'une même famille verticale de la classification périodique (voir figure ci-dessous).
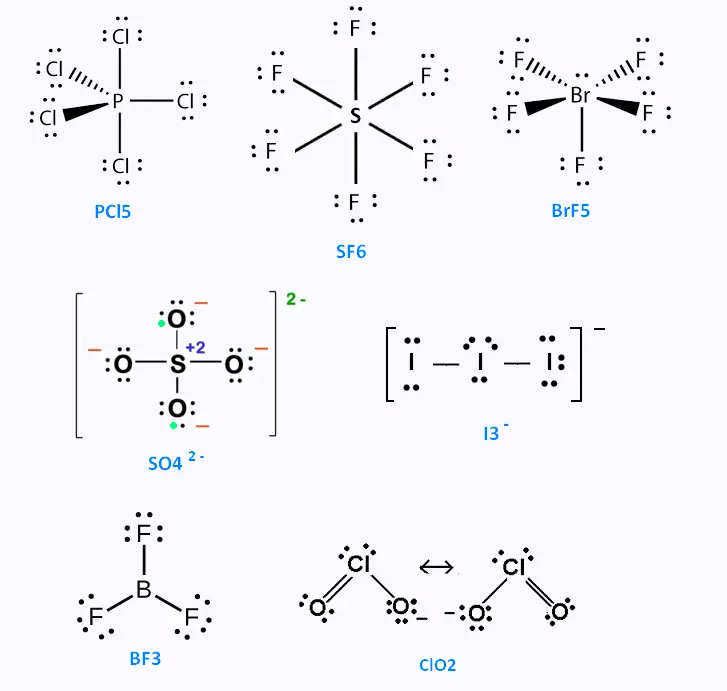
2. Exceptions à la règle de l'octet
Dans quelques molécules, le nombre d'électrons de valence est impair. C'est le cas
du monoxyde d'azote ou du dioxyde de chlore CLO2. L'un des atomes dans un ensemble
ne respècte pas la règle de l'octet.
Dans certains cas, comme dans la molécule BF3, l'atome de Bore ne respecte pas
la règle de l'octet. Il fait 3 liaisons simples avec les atomes du
fluor.
Dans certaines molécules ou ions, où les atomes centrales sont des atomes
de la troisième période , comme le phosphore (P), le
soufre (S) ou le chlore (Cl) ; ou de la quatrième période, comme le
brome (Br), ces atomes ne respectent pas toujours la r`gle de l'octet.
C'est le cas du phosphore dans la molécule PBl5.
Voici des exemples de molécules où ses atomes sont présents:
|
|