Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 :
Piles et oxydo-réduction
Les réactions d'oxydo-réduction
Exercices résolus
Accuumulateur lithium-ion
Les accumulateurs lithium-ion alimentent des téléphones et
ordinateurs portables, des voitures électriques, etc.,
car ils ont des caractéristiques très intéressantes.
Lorsqu’un accumulateur lithium-ion débite un courant,
l’électrode de graphite est le lieu de la réaction d’équation :
Li (graphite) --> (graphite) + Li+ + e–
À l’autre électrode a lieu la réaction d’équation :
CoO2 + Li+ + e– --> CoLiO2
1. Le lithium est-il oxydé ou réduit à l’électrode de graphite ?
2. Cette électrode constitue-t-elle le pôle positif de l’accumulateur ?
Justifier la réponse.
3. Écrire l’équation bilan de la réaction de fonctionnement
en générateur de l’accumulateur.
4. Quels sont les porteurs de charge responsables du passage du courant dans les différentes parties du circuit ?
5. Quel est le réactif qui limite la durée de fonctionnement de l’accumulateur en générateur ?
6)- Lorsque l’accumulateur est déchargé, on le recharge en le reliant à un générateur électrique. La réaction traduisant la charge est l’inverse de celle qui se produit lors de la décharge.
a) Quel doit être alors le sens de déplacement des électrons dans le circuit extérieur à l’accumulateur ?
b) Pour cela, à quelle électrode doit-on relier la borne positive du générateur électrique ?
c) Quel est la transformation d’énergie qui a lieu dans l’accumulateur lors de la charge ?
Réponses
1. Réaction du lithium :
Le lithium subit la réaction suivante :
Li (graphite) --> (graphite) + Li+ + e–
• Cette réaction cède des électrons : c’est une oxydation.
• Le lithium est oxydé.
2. L’électrode de graphite :
Cette électrode où se produit l’oxydation du
lithium est la borne négative du générateur,
c'est l’anode.
3.Équation bilan de la réaction :
Li (graphite) --> (graphite) + Li+ + e–
CoO2 + Li+ + e– --> CoLiO2
Li (graphite) + CoO2 --> (graphite) + CoLiO2
4 Réactif limitant de l’accumulateur :
Le réactif limitant est le lithium, car il est oxydé
à l’électrode de graphite en ions Li+.
Ces ions Li+ se déplacent vers l’autre électrode constituée
d’oxyde de cobalt CoO2 à l’intérieur de l’accumulateur.
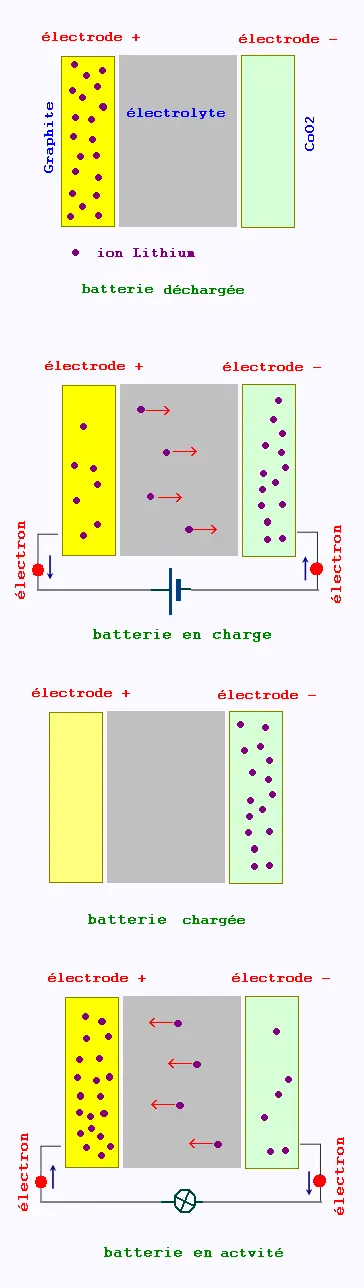
5. Étude du fonctionnement en générateur :
Les porteurs de charge responsables du passage du courant
dans les différentes parties du circuit sont :
• Les électrons à l’extérieur du générateur.
• Les ions lithium à l’intérieur du générateur.
6. Charge de l’accumulateur :
a) Sens de déplacement des électrons dans ce cas :
Les électrons doivent circuler dans le sens inverse
dans ce cas, c’est-à-dire de l’électrode constituée
d’oxyde de cobalt CoO2 vers l’électrode de graphite
à l’extérieur de l’accumulateur.
b) Branchement du générateur qui permet la
charge de l’accumulateur.
Dans ce cas, le générateur impose le sens du courant
dans le circuit. Le courant sort de la borne positive de ce générateur.
• Les électrons circulent dans le sens inverse du sens du courant.
• La borne négative du générateur est reliée à l’électrode de
graphite de l’accumulateur.
c) Transformation d’énergie qui a lieu dans l’accumulateur lors de la charge :
• Lors de la charge de l’accumulateur par le générateur, on transforme de l’énergie électrique en énergie chimique.
•Il se produit les réactions inverses aux niveaux des électrodes.
• On réalise une électrolyse.
• On transforme de l’énergie électrique en énergie chimique.
|
|