Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 :
Transformation d'énegie
Énergie thermique
La combustion des carburants
1. La combustion des hydrocarbures
1.1. Définition d'une combustion
Lorsqu'on brûle un composé carbonique comme le bois,
dans l'atmosphère , le principal composant du bois,
le carbone et l’un des composants de l’air, l’oxygène
(l’azote est présent mais n’intervient pas dans la
combustion) réagissent entre eux.
Le résultat, outre un dégagement de chaleur,
est la formation de dioxyde de carbone (CO2), et
de l'eau (H2O).
Au moment de la combustion du carburant, si la
température est suffisante, le carbone (C) et l’hydrogène (H),
par ailleurs faiblement liés au sein de la molécule d’hydrocarbure,
se séparent et capturent l’oxygène de l’air (O2)
pour former du dioxyde de carbone (CO2) et de l’eau (H2O).
L'intérêt de cette réaction, c'est qu'elle libère une grande quantité
d’énergie, principalement sous forme de chaleur.
1.2. La combustion des hydrocarbures
Les lois de la stœchiométrie appliquées à la combustion des
hydrocarbures montrent que :
• Pour brûler 1 kilogramme de gazole, il faut disposer d’environ 14,6 kilogrammes
d'air (soit, étant donné la composition de l’air, environ 11.2 kilogrammes d’azote et 3.4
kilogrammes d’oxygène) ; la réaction produit environ 11,2 kilogrammes d’azote (ce gaz
étant chimiquement neutre, il n’a pas participé à la combustion), 3.2 kilogrammes de
dioxyde de carbone (CO2) et 1.2 kilogramme d’eau (H2O).
• Pour brûler 1 kilogramme d'essence, il faut disposer d'environ 15.3 kilogrammes
d’air (soit, étant donné la composition de l’air, environ 11.8 kilogrammes d’azote et 3.5
kilogrammes d’oxygène) ; la réaction produit environ 11.8 kilogrammes d’azote (ce gaz
étant chimiquement neutre, il n'a pas participé à la combustion), 3.1 kilogrammes de
dioxyde de carbone (CO2) et 1.4 kilogramme d’eau (H2O).
• Pour brûler 1 kilogramme de GPL, il faut disposer d'environ 15.6 kilogrammes d’air
(soit, étant donné la composition de l’air, environ 12 kilogrammes d'azote et 3.6
kilogrammes d’oxygène) ; la réaction produit environ 12 kilogrammes d’azote (ce gaz étant
chimiquement neutre, il n’a pas participé à la combustion), 3 kilogrammes de dioxyde de
carbone (CO2) et 1.6 kilogramme d’eau (H2O).
2. Formule chimique fictive des
hydrocarbures
N.B. Il s'agit ici des indices fictifs. Ce ne sont
pas les vrais indices des composés organiques
comme les alcanes, les alcènes ou les alcynes.
Formule chimique du gazole :
composition massique du gazole :
carbone (C) 87 % ; hydrogène (H) 13 %
indice du carbone : 87 / 12 = 7,25 ;
indice de l’hydrogène : 13 / 1 = 13
formule chimique : C7,25H13
Formule chimique de l’essence :
composition massique de l’essence :
carbone (C) 84 % ; hydrogène (H) 16 %
indice du carbone : 84 / 12 = 7 ;
indice de l’hydrogène : 16 / 1 = 16
formule chimique : C7H16
Formule chimique du GPL :
composition du GPL :
butane (C4H10) 50 % ; propane (C3H8) 50 %
formule chimique approchée : C3.5H9
3. Équation de combustion d'un HC
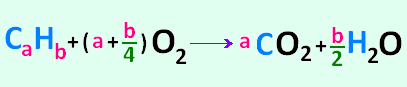
4. Réactions chimiques des carburants
Combustion du gazole :
C7.25H13 + 10.5 O2 + (10.5 x 3.8) N2 -->
7.25 CO2 + 6.5 H2O + 40 N2
C7.25H13 : gazole
O2 : dioxygène
N2 : diazote
CO2 : dioxyde de carbone
H2O : eau
À partir de la masse molaire de chaque élément présent dans la réaction, on obtient les proportions suivantes :
1 kg de gazole + 3.36 kg de dioxygène + 11.2 kg de diazote
-->
3.19 kg de CO2 + 1.17 kg d’eau + 11.2 kg de diazote
À partir de la masse volumique de chaque corps intervenant dans la réaction, on obtient les proportions suivantes :
1 litre de gazole + 1 985 litres de dioxygène + 7 570 litres de diazote
-->
1 375 litres de CO2 + 1 litre d’eau + 7 570 litres de diazote
Combustion de l’essence :
C7H16 + 11 O2 + (11 x 3.8) N2 -->
7 CO2 + 8 H2O + 42 N2
C7H16 : essence
O2 : dioxygène
N2 : diazote
CO2 : dioxyde de carbone
H2O : eau
À partir de la masse molaire de chaque élément présent dans la réaction, on obtient
les proportions suivantes :
1 kg d’essence + 3.52 kg de dioxygène + 11.76 kg de diazote
-->
3,08 kg de CO2 + 1.44 kg d’eau + 11.76 kg de diazote
À partir de la masse volumique de chaque corps intervenant dans la réaction, on
obtient les proportions suivantes :
1 litre d’essence + 1 870 litres de dioxygène + 7 150 litres de diazote
-->
1 195 litres de CO2 + 1.1 litre d’eau + 7 150 litres de diazote
Combustion du GPL :
C3.5H9 + 5.75 O2 + (5.75 x 3.8) N2 -->
3.5 CO2 + 4.5 H2O + 22 N2
C3.5H9 : GPL
O2 : dioxygène
N2 : diazote
CO2 : dioxyde de carbone
H2O : eau
À partir de la masse molaire de chaque élément présent dans la réaction, on obtient
les proportions suivantes :
1 kg de GPL + 3.6 kg de dioxygène + 12 kg de diazote
-->
3 kg de CO2 + 1.6 kg d’eau + 12 kg de diazote
À partir de la masse volumique de chaque corps intervenant dans la réaction, on
obtient les proportions suivantes :
1 litre de GPL + 1 390 litres de dioxygène + 5 320 litres de diazote
-->
850 litres de CO2 + 0.875 litre d’eau + 5 320 litres de diazote
|
|