Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 : Structure de la matière
La structure des molécules
Liaisons chimiques
Pour decrire une liaison chimique entre deux atomes, trois modèles
sont utilisés: Le modèle de Lewis, Le modèle de la liaison
de valence, puis le modèle des orbitales moléculaires. Ces deux
derniers font appel à la théorie quantique.
1.Représentation de Lewis d'une molécule
ou d'un ion polyatomique
• Dans l'établissement des liaisons, seuls les électrons
périphériques interviennent.
• Une liaison covalente est constituée de deux électrons: doublets
d'électrons . Les électrons engagés dans cette liaison peuvent
provenir des deux atomes liés où chacun en apporte un, ou d'un seul des
deux atomes liés , on parle donc d'une liaison de coodrination .
• Dans une liaison chimique, chaque atome ne peut avoir plus de 8 électrons
sur sa couche périphérique, c'est la règle de l'octet, ou
plus de 2 électrons pour l'atome d'hydrogène, c'est la règle du duet.
• La représentation, ou formule, de Lewis d'une molécule
ou d'un ion polyatomique fait apparaître les liaisons entre atomes
par des traits: - doublets liants , ou deux points : .. doublets non
liants .
• Pour connaitre le nombre de doublets qui doivent apparaître dans la
représentation, on calcule le nombre total des électrons de valence des
atomes, puis on les répartit par paires. Chaque atome est entouré d'un octet
d'électrons, soit 4 doublets liants et non-liants.
Exemples:
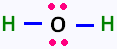
1. La molécule d'eau: 2 x (1 ev pour H ) + 6 ev pour O = 8,
donc 4 paires, soit 4 doublets:
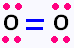
2. La molécule d'O2: 2 x( 6 ev pour O ) = 12,
donc 6 paires, soit 6 doublets:
Exercice:
Quel est le nombre de doublets dans les molécules ou ions polyatomiques
suivants?
Donner leurs représentations de Lewis:
H2, HCl, NH3, O2, N2,CH4, C2H4, C2H2, NH4+, H3O+, HO -
La représentation de Lewis montre la répartition des liaisons dans les
molécules ou les ions polyatomiques. Cependant, elle :
• ne permet pas d'expliquer l'existence d'une molécule comme PCl5,
• ne différencie pas les deux liaisons entre les atomes d'oxygène
dans la molécule de O2, alors que celles-ci ne sont pas équivalentes.
• ne donne aucune indication sur la répartition des liaisons dans
l'espace, donc sur la géométrie des molécules.
2. Charge formelle d'un atome
La charge formelle d'un atome cf dans un composé
est égale à la différence entre le nombre de ces électrons de valence
(Nv),lorsqu'il est isolé, et du nombre d' électrons attribués
(Na) lorsqu'il est placé dans une molécule : cf = Nv - Na
cf = Nv - Na
Exemples:
L'ion polyatomique méthanoate CH3O -
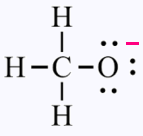
Le nombre de doublets = (3 x (1 ev de H) + 4 ev de C + 6 ev de O +
1 électron emprunté ) /2 = 14/2 = 7
Autour des 3 H, loi du duet satisfaite: un des leurs et un du C.
Autour de C loi de l'octet satisfaite: 4 de lui , 3 des H et 1 du O.
Autour de O loi du duet satisfaite: 6 de lui, 1 du C et 1 emprunté
pour formé l'ion.
Ainsi l'oxygène poss`de un doblets liant et 3 doublets non-liants.
Pour l'atome d'oxygène: cf = Nv - Na = 6 - 7 = - 1
Dans l'ion méthanoate, l'oxygène porte une charge formelle de - 1.
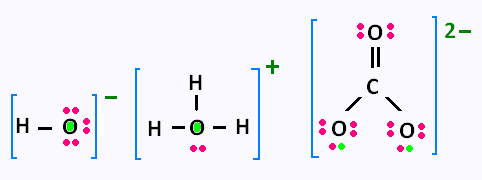
Exercice résolu:
Compléter les formules de Lewis des ions polyatomiques suivants:
HO - , H3O + , CO3 2- , et faire apparaître
leurs charges formelles.
Réponse:
|
|