Sciences
Physiques 1ère S
Ondes et phénomènes
périodiques
Mécanique
Électricité & Magnétisme
Thermodynamique
Physique nucléaire
Physique Atomique
Optique
Les solutions aqueuses
Structure de la matière
Les familles chimiques
Les réactions chimiques
La combustion des carburants
© The scientific sentence. 2010
| |
|
Chimie23 : Structure de la matière
La structure des molécules
Liaisons chimiques
VSEPR
1. La théorie VSEPR
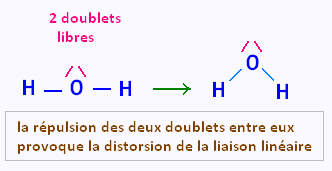
La théorie VSEPR prévoit la forme d'une molécule.
En 1957, le chimiste canadien R.J Gillespie a développé la théorie ou méthode appelée VSEPR: Valence Shell Electron Pair Repulsion.
Son principe repose sur le fait suivant:
La structure d'une molécule se fait de
sorte que la répulsion entre les paires d'électrons
dans l'atome central soit minimale.
Du fait que les doublets électroniques de la couche de valence se repoussent entre eux , cela permet alors de prévoir, à partir d’un schéma de Lewis, la géométrie de la molécule.
La géométrie de l'ensemble sera celle pour laquelle les répulsions
sont minimales, soit, les doublets électroniques sont les plus éloignés possibles.
Voici l'exemple de la molécule d'eau:
1. La méthode VSEPR
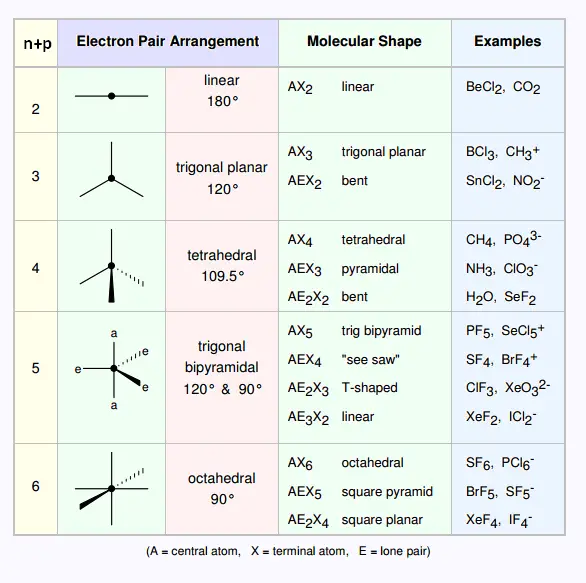
La molécule est symbolisée par : A Xn Ep
A : atome central
X : ligand, avec un nombre n
E : doublet électronique libre , de nombre p .
Sans la présence de paires non liantes, la molécule est symbolisée par : A Xn
|
|