Physique
Chimie
Électricité
Mathématiques
Calculateurs Scientifiques
© The scientific sentence. 2010

| |
|
Articles
Science and societies
La décantation
La décantation
Avec un solvant approprié
 • La décantation
• La décantation
La décantation est la séparation de plusieurs phases
non-miscibles de densités différentes sous l'effet de
la gravitation .
Elle permet aussi de séparer des solides insolubles
en suspension dans un liquide ou un gaz.
En milieu naturel, ce procédé est appelé sédimentation.
Lorsque deux liquides ne sont pas miscibles, comme l'huile
et l'eau, il suffit de laisser reposer leur mélange pour
que le liquide le moins dense se place en dessus du
liquide le plus dense. Il apparait alors une surface de
séparation horizontale entre les deux liquides.
Souvent dans les laboratoires de chimie ou de biologie on utilise
couramment ce procédé lors des extractions liquide-liquide
impliquant une phase aqueuse et une phase organique.
L'expérience de la décantation est simple: on transvase le contenu
du ballon d'um mélange dans une ampoule à décanter et on y ajoutant
un solvant extracteur .
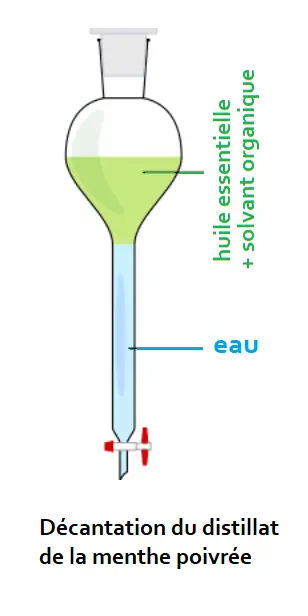
• Application: Extraction de l'huile essentielle de son distillat
Après une hydrodistillation, on transvase le contenu du cylindre
gradué dans une ampoule à décanter et on y un solvant extracteur .
On agite puis on laisse reposer. On observe la séparation de 2 phases,
la phase organique surnageant.
• Choix du solvat extracteur
Quel solvant faut-il utiliser et pourquoi?
Dans une extraction liquide-liquide, extraction d’une espèce chimique
présente dans une solution, on doit choisir un solvant approprié pour
extraire un composé chimique présent dans une solution.
Critères pour le choix du solvant :
• Le solvant d’extraction ne doit pas être miscible avec
la solution étudiée (solution acqueuse = solvant initial),
afin de pouvoir constituer deux phases distinctes et facilement
séparables. Généralement, Il se forme deux phases: une est polaire
et l’autre apolaire.
• L’espèce chimique à extraire doit être beaucoup plus soluble dans le solvant
d’extraction que dans le solvant de départ, mais pas
dans les autres constituants .
• Exemple : Extraction de la menthone de la menthe
Il est toutefois difficile de séparer directement l'huille essentielle de la phase
aqueuse. Après une hydrodistillation, on réalise alors une extraction avec un solvant
organique, au moyen d'une ampoule à décanter.
L’objectif de cette extraction est de séparer la phase organique
contenant la majorité des composés odorants de la phase aqueuse.
L’huile essentielle est très soluble dans un solvant organique.
La phase aqueuse n’en contient que très peu de ses composés odorants.
On extrait de L'huille essentielle de la menthe par une
une hydrodistillation. Au hydrodistillat obtenu on ajoute le
solvant extracteur. Il est ensuite versé dans une ampoule à
décanter.
On mélange la solution avec le solvant choisi puis on les agite afin
que le solvant dissolve l’espèce chimique désirée, et on laisse reposer.
Voici un tableau pour faire un choix:
| solvant | solubilité de la menthone |
solubilité dans l'eau | densité |
| eau | peu soluble | ...... | 1 |
| toluène | très soluble | non soluble | 0.87 |
| éthanol | très soluble | totalement missible | 0.79 |
À l'aide des données de ce tableau, choisir le solvant approprié pour cette extraction.
Expliquer votre choix.
La densité du toluène ou celle de l'éthanol est plus faible que celle
de l’eau: la phase organique sera donc au-dessus de la phase
aqueuse. La phase organique contient le toluène ou l'éthanol et quasiment
toute l’huile essentielle et la phase aqueuse contient de l’eau
et des traces d’huile essentielle.
La menthone doit être très soluble dans ce solvant extracteur. Ceci est
vrai pour les deux solvants organiques le toluène ou l'éthanol.
Le solvant extracteur (le toluène ou l'éthanol) ne doit pas être miscible
avec l'eau (solvant initial). Ce n'est pas le cas de l'ethanol.
C'est donc le toluène .
• Le toluène, un solvant approprié pour les huiles
Le toluène , ou méthylbenzène ou phénylméthane de formule
brute, C7H8, est un hydrocarbure aromatique. C'est un liquide
transparent. Il est couramment utilisé en tant que solvant
ou réactif.
La formule brute C7H8 possède 3 isomères. Le toluène , la cycloheptatriène ,
et la norbornadiène . Chacun de ces isomères et une espèce chimique.
Le toluène est une espèce chimique moléculaire organique.
On rappelle que des molécules sont dites isomères
lorsqu'elles ont la même formule brute mais des structures
différentes. Il y a donc isomérie si deux molécules ont exactement
des mêmes atomes mais qu'ils s'enchaînent de manière différente.
Espèce chimique moléculaire
Elle est composée d’entités chimiques qui sont des molécules identiques représentées par des formules (brutes ou développées) identiques.
-- Abdurrazzak Ajaja
fevrier 2015
|
|